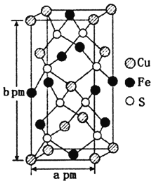
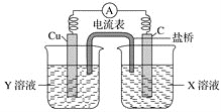
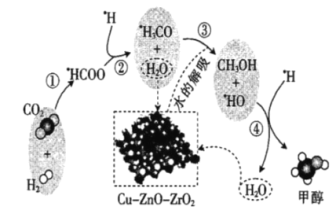
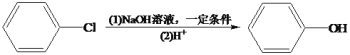题目内容
【题目】下列粒子的中心原子形成sp3杂化轨道且该粒子的空间构型为三角锥形的是( )
A.SO42-B.CH3-C.ClO2-D.[PCl4]+
【答案】B
【解析】
A.SO42-中心原子为S,价层电子对数=4+![]() ×(8-4×2)=4,杂化方式为sp3杂化,空间构型为正四面体,故A不符合题意;
×(8-4×2)=4,杂化方式为sp3杂化,空间构型为正四面体,故A不符合题意;
B.CH3-中心原子为C,价层电子对数=3+![]() ×(5-3)=4,杂化方式为sp3杂化,空间构型为三角锥形,故B符合题意;
×(5-3)=4,杂化方式为sp3杂化,空间构型为三角锥形,故B符合题意;
C.ClO2-中心原子为Cl,价层电子对数=2+![]() ×(8-2×2)=4,杂化方式为sp3杂化,空间构V型,故C不符合题意;
×(8-2×2)=4,杂化方式为sp3杂化,空间构V型,故C不符合题意;
D.[PCl4]+ 中心原子为P,价层电子对数=4+![]() ×(4-4)=4,杂化方式为sp3杂化,空间构型为正四面体,故D不符合题意;
×(4-4)=4,杂化方式为sp3杂化,空间构型为正四面体,故D不符合题意;
答案选B。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH =-196.6kJ/mol,测得反应的相关数据如下:
2SO3(g);ΔH =-196.6kJ/mol,测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度 T/K | 700 | 700 | 800 |
反应物投入量 | 2molSO2、1mol O2 | 4molSO3 | 2molSO2、1mol O2 |
平衡v正(SO2)/ mol·L-1 ·s-1 | v1 | v2 | v3 |
平衡c(SO3)/ mol·L-1 | c1 | c2 | c3 |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(O2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是 ( )
A.v1<v2,c2<2c1B.K1>K3 ,p2>2p3
C.v1<v
【题目】(1)t1 ℃时,密闭容器中,通入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位: mol·L-1)变化如下表所示:
CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位: mol·L-1)变化如下表所示:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①一定处于平衡状态的时间段为____________。
②5~6 min时间段内,平衡移动方向为_______________ (填“向左移动”或“向右移动”),根据表中数据判断,平衡移动的原因是________(填字母编号)。
a.增加了H2O(g)的量 b.增加氢气浓度 c.使用催化剂 d.降低温度
③t2 ℃时(t2>t1),在相同条件下发生上述反应,达平衡时,CO浓度________c1(填“>”“<”或“=”)。
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:
FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:
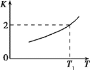
①用CO还原FeO制备Fe的反应是___________ (填“吸热”或“放热”)反应。
②温度为T2时,实验测得该反应体系中CO浓度为CO2的2.5倍,则T2______T1(填“>”“<”或“=”)。
(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH<0;②CO2(g)+H2(g)
CH3OH(g) ΔH<0;②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图所示。
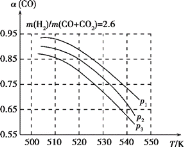
图中的压强由大到小的顺序为____________,判断理由是_________________________;
试解释CO平衡转化率随温度升高而减小的原因是_______________________。