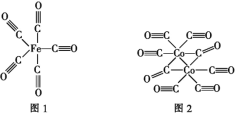
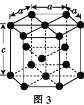
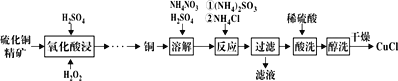
题目内容
【题目】已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O | K1=1.75×10-5mol·L-1 |
CH3COO-+H2O | K2=5.71×10-10mol·L-1 |
现将 50 mL 0.2 mol·L-1醋酸与 50 mL 0.2 mol·L-1醋酸钠溶液混合制得溶液甲,下列叙述正确的是
A.溶液甲的pH>7
B.对溶液甲进行微热,K1、K2同时增大
C.若在溶液甲中加入少量的 NaOH 溶液,溶液的 pH 明显增大
D.若在溶液甲中加入 5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的 K1 会变大
【答案】B
【解析】
A.K2<<K1,所以醋酸电离程度比醋酸钠的水解程度大,所以溶液呈酸性,pH<7,A错误;
B.因为电离和水解都是吸热反应,温度升高有利于吸热反应进行,所以K1,K2都增大,B正确;
C.加入少量NaOH,反而会促使醋酸更进一步的电离,所以PH不会明显增大,C错误;
D.溶液中加入盐酸会抑制醋酸电离,K1减小,D错误;
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】(1)t1 ℃时,密闭容器中,通入一定量的CO和H2O,发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位: mol·L-1)变化如下表所示:
CO2(g)+H2(g) ΔH<0。容器中各物质浓度(单位: mol·L-1)变化如下表所示:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①一定处于平衡状态的时间段为____________。
②5~6 min时间段内,平衡移动方向为_______________ (填“向左移动”或“向右移动”),根据表中数据判断,平衡移动的原因是________(填字母编号)。
a.增加了H2O(g)的量 b.增加氢气浓度 c.使用催化剂 d.降低温度
③t2 ℃时(t2>t1),在相同条件下发生上述反应,达平衡时,CO浓度________c1(填“>”“<”或“=”)。
(2)已知反应Fe(s)+CO2(g)![]() FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:
FeO(s)+CO(g)的平衡常数随温度变化情况如图所示:

①用CO还原FeO制备Fe的反应是___________ (填“吸热”或“放热”)反应。
②温度为T2时,实验测得该反应体系中CO浓度为CO2的2.5倍,则T2______T1(填“>”“<”或“=”)。
(3)工业上常用CO、CO2和H2合成甲醇燃料,其原理为:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH<0;②CO2(g)+H2(g)
CH3OH(g) ΔH<0;②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
当混合气体的组成固定时,CO平衡转化率(α)与温度和压强的关系如图所示。

图中的压强由大到小的顺序为____________,判断理由是_________________________;
试解释CO平衡转化率随温度升高而减小的原因是_______________________。