题目内容
14.下列各组物质中,按酸、碱、盐、碱性氧化物、酸性氧化物的顺序排列正确的是( )| A. | 盐酸、纯碱、氣酸钾、氧化镁、二氧化硅 | |
| B. | 硝酸、烧碱、次氯酸钠、氧化钙、二氧化硫 | |
| C. | 次氯酸、消石灰、硫酸铵、过氧化钠、二氧化碳 | |
| D. | 氨基酸、过氧化钠、碱式碳酸铜、氧化铁、一氧化碳 |
分析 电离生成的阳离子全部是氢离子的化合物是酸;电离生成的阴离子全部是氢氧根离子的化合物是碱;能电离出金属阳离子(或铵根离子)和酸根离子的化合物是盐;能跟酸起反应,生成盐和水的氧化物叫碱性氧化物;酸性氧化物能与水作用成酸或与碱作用成盐和水的氧化物.
解答 解:A.盐酸、纯碱、氯酸钾、氧化镁、二氧化硅分别属于酸、盐、盐、碱性氧化物、酸性氧化物,故A错误;
B.硝酸、烧碱、次氯酸钠、氧化钙、二氧化硫分别属于酸、碱、盐、碱性氧化物、酸性氧化物,故B正确;
C.次氯酸、消石灰、硫酸铵、过氧化钠、二氧化碳分别属于酸、碱、盐、过氧化物、酸性氧化物,故C错误;
D.氨基酸、过氧化钠、碱式碳酸铜、氧化铁、一氧化碳分别属于氨基酸类、过氧化物、盐、碱性氧化物、不成盐氧化物,故D错误;
故选:B.
点评 本题是一道有关物质的分类的题目,熟记各种类型的物质的概念是解题的关键,注意过氧化钠不是碱性氧化物、一氧化碳不是酸性氧化物,题目较简单.

练习册系列答案
相关题目
4.10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强.乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度大于(填“大于”或“小于”)NaHCO3
(2)丙同学认为甲、乙的判断都不充分.丙认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)判断正确.试剂X是B.
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
②将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则甲(填“甲”或“乙”)判断正确.
③查阅资料,发现NaHCO3的分解温度为150℃,丙断言乙(填“甲”或“乙”)判断是错误的,理由是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃.
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
(2)丙同学认为甲、乙的判断都不充分.丙认为:
①只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则乙(填“甲”或“乙”)判断正确.试剂X是B.
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
②将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则甲(填“甲”或“乙”)判断正确.
③查阅资料,发现NaHCO3的分解温度为150℃,丙断言乙(填“甲”或“乙”)判断是错误的,理由是常压下加热NaHCO3的水溶液,溶液的温度达不到150℃.
5.由2-氯丙烷制得少量的HOCH2CH(OH)CH3 需要经过下列几步反应( )
| A. | 消去→加成→水解 | B. | 加成→消去→取代 | C. | 取代→消去→加成 | D. | 消去→加成→消去 |
2.下列说法中错误的是( )
| A. | 化学反应必然伴随发生能量变化 | |
| B. | 化学反应中能量变化的大小与反应物的状态有关 | |
| C. | 化学变化中的能量变化全部是由化学键变化引起的 | |
| D. | 能量变化是化学反应的基本特征之一 |
9.下列物质对应关系正确的是( )
| A. | 淀粉检验方法:加碘化钾变蓝 | B. | 蛋白质检验方法:浓硝酸或燃烧法 | ||
| C. | 蛋白质最终水解产物:葡萄糖 | D. | 淀粉最终水解产物:二氧化碳 |
19.下列实验能成功的是( )
| A. | 氯乙烷与NaOH溶液共热,在水解后的溶液中加入硫酸,再加入AgNO3溶液检验Cl- | |
| B. | 将电石和水反应后的气体通入溴水中,如果溴水褪色,证明乙炔和溴发生了反应 | |
| C. | 实验室制溴苯时,将苯与液溴混合后加到有铁丝的反应容器中 | |
| D. | 向苯酚浓溶液中滴入少量浓溴水可观察到白色三溴苯酚沉淀 |
3.能与Na反应放出H2,又能是溴水褪色,但不能使石蕊试纸变红色的物质是( )
| A. | CH3-CH2-COOH | B. | CH2=CH-CH2-OH | C. | CH2=CH-COOH | D. | CH2=CH-COOCH3 |
4.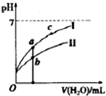 (1)25℃时,下列4种溶液.请回答下列问题.
(1)25℃时,下列4种溶液.请回答下列问题.
A.0.01 mol•L-1 氨水 B.0.01mol•L-1 NaOH 溶液
C.pH=2的CH3COOH溶液 D.pH=2的HCl溶液
①上述4种溶液中,水的电离程度最大的是A(填序号);
②若将C、D溶液分別稀释10倍,pH变化如图,判断曲线I对应的溶液为D(填序号),图中a、b、c三点对应溶液的导电能力由强到弱的顺序是b>a>c.(用a、b、c 表示)
③若将B、C溶液等体积混合,所得溶液的pH<7(填“>”、“<”或“=”).
(2)已知25℃:
①一元酸H3PO2:的电离方程式为H3PO2?H2PO2-+H+;
②H2S溶液与NaA溶液反应的化学方程式为H2S+NaA=NaHS+HA;
③经测定,25℃时,0.01 mol•L-1 Na2S溶液的PH为11,则:
c(H+)+c(HS-)+2c(H2S)=1.0×10-3mol/L.
 (1)25℃时,下列4种溶液.请回答下列问题.
(1)25℃时,下列4种溶液.请回答下列问题.A.0.01 mol•L-1 氨水 B.0.01mol•L-1 NaOH 溶液
C.pH=2的CH3COOH溶液 D.pH=2的HCl溶液
①上述4种溶液中,水的电离程度最大的是A(填序号);
②若将C、D溶液分別稀释10倍,pH变化如图,判断曲线I对应的溶液为D(填序号),图中a、b、c三点对应溶液的导电能力由强到弱的顺序是b>a>c.(用a、b、c 表示)
③若将B、C溶液等体积混合,所得溶液的pH<7(填“>”、“<”或“=”).
(2)已知25℃:
| 物质 | H3PO2 | H2S | 一元酸HA |
| Kn | Kn=5.9×l0-2 | Kn1=9.1×l0-8 Kn2=l.l×l0-12 | Kn=l.1×1O-10 |
②H2S溶液与NaA溶液反应的化学方程式为H2S+NaA=NaHS+HA;
③经测定,25℃时,0.01 mol•L-1 Na2S溶液的PH为11,则:
c(H+)+c(HS-)+2c(H2S)=1.0×10-3mol/L.
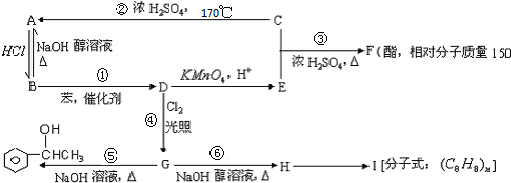



 .
.