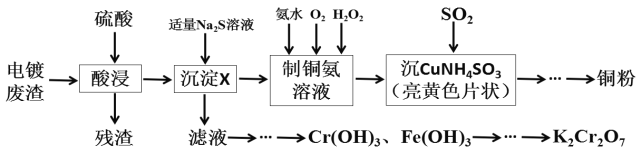
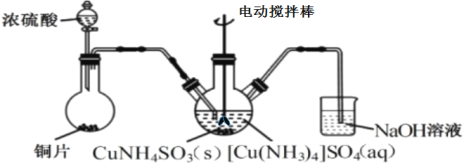
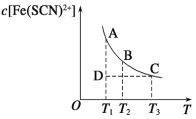
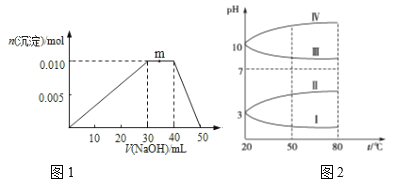
题目内容
【题目】氯化铁和摩尔盐是铁的两种重要盐类,在净水和定量分析等方面具有重要作用。
(1)用FeCl3溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉,对加入铁粉充分反应后的溶液分析合理的是__________。
a.若无固体剩余,则溶液中一定有Fe3+ b.若有固体存在,则溶液中一定有Fe2+
c.若溶液中有Cu2+,则一定没有固体析出 d.若溶液中有Fe2+,则一定有Cu析出
(2)工业上通过氧化酸性FeCl2废液得到含FeCl3的溶液。若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为____(不考虑水的电离和离子的水解)。
(3)摩尔盐[(NH4)2Fe(SO4)2·6H2O]在定量分析中常作为基准物质,用来标定重铬酸钾、高锰酸钾等溶液的浓度,在0.1mol·L-1 的该盐的溶液中,离子浓度由大到小的顺序是____
(4)配平离子方程式:___Fe2+ +___ MnO4- +____ H+ → ___Mn2+ +____Fe3+ +___ H2O
(5)已知摩尔盐相对分子质量为M=392,取摩尔盐产品23.520g(杂质不与高锰酸钾反应),配成250mL溶液,取出25mL用0.0500mol·L-1 KMnO4溶液滴定,消耗KMnO4溶液19.50mL,则产品中莫尔盐的质量分数为__________(用小数表示,保留四位小数)。
【答案】b 2 SO42->NH4+>Fe2+>H+>OH- 5 1 8 1 5 4 0.8125
【解析】
(1)FeCl3溶液腐蚀印刷电路版上的铜,发生的离子反应为2Fe3++ Cu= 2Fe2++Cu2+,氧化性顺序为Fe3+> Cu2+> Fe2+,所得的溶液中加入铁粉,可能发生反应Fe+ Cu2+= Cu +Fe2+,Fe +2Fe3+=3Fe2+。
a.若无固体剩余,当铁粉刚好与Fe3+恰好完全反应,溶液不存在Fe3+,故a错误;
b.无论铁粉的量如何,只要发生反应,溶液中就一定存在Fe2+,故b正确;
c.若溶液中有Cu2+,说明铁粉不足,可能有固体析出,故c错误;
d. 因为氧化性顺序为Fe3+> Cu2+,加入少量铁粉,溶液中一定存在Fe2+,不一定有Cu析出,故d错误;
综上所述,本题正确答案为b。
(2)根据电荷守恒:c(Cl-)=2c(Fe2+)+3c(Fe3+)+c(H+)(酸性溶液中OH-浓度很小,可以忽略不计,则c(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=1.0×10-2molL-1,则溶液pH=-lg1.0×10-2=2。所以答案为:2。
(3)摩尔盐[(NH4)2Fe(SO4)2·6H2O]溶解形成的溶液中存在铵根离子、亚铁离子、硫酸根离子,铵根离子、亚铁离子水解显酸性,最大的是硫酸根离子,其次是铵根离子浓度、亚铁离子浓度、氢离子浓度和氢氧根离子浓度,离子浓度大小为: c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-);所以答案:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)>c(OH-)。
(4)先根据得失电子相等,配平氧化剂和还原剂及其产物,分别是1 MnO4-被还原为1 Mn2+,5 Fe2+被氧化为5Fe3+;再根据电荷守恒或者氧、氢原子守恒即可得到:8 H+ ,4 H2O ,所以配平离子方程式的系数分别为5、1、 8、1、 5、 4 ;所以答案为 5、1、 8、1、 5、 4。
(5)消耗的高锰酸钾的物质的量为:0.0500mol/L×0.0195L=9.75×10-4mol,250mL溶液中需要消耗的高锰酸钾的物质的量为:9.75×10-4mol×![]() =9.75×10-3mol,根据反应5Fe2++MnO4-+8H+=5Fe2++Mn2++4H2O,亚铁离子的物质的量为:n(Fe2+)=5n(MnO4-)=5×9.75×10-3mol=4.875×10-2mol,莫尔盐产品23.520g中含有的莫尔盐质量为:392g/mol×4.875×10-2mol=19.11g,产品中莫尔盐的质量分数为:
=9.75×10-3mol,根据反应5Fe2++MnO4-+8H+=5Fe2++Mn2++4H2O,亚铁离子的物质的量为:n(Fe2+)=5n(MnO4-)=5×9.75×10-3mol=4.875×10-2mol,莫尔盐产品23.520g中含有的莫尔盐质量为:392g/mol×4.875×10-2mol=19.11g,产品中莫尔盐的质量分数为:![]() =0.813;故答案为:81.3%。
=0.813;故答案为:81.3%。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案