题目内容
【题目】25℃时,水的电离达到平衡:H2O=H++OH-,下列叙述正确的是( )
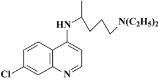
A.![]() 表示的粒子不会对水的电离平衡产生影响
表示的粒子不会对水的电离平衡产生影响
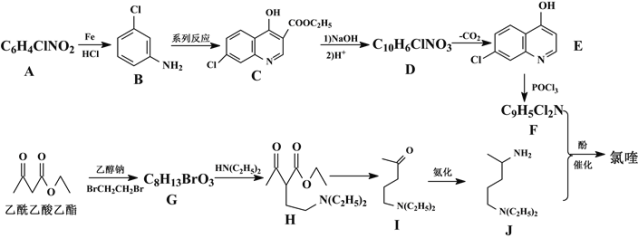
B.![]() 表示的物质加入水中,促进水的电离,c(H+)增大
表示的物质加入水中,促进水的电离,c(H+)增大
C.25℃时,CH3COO-加入水中,促进水的电离,Kw不变
D.水的电离程度只与温度有关,温度越高,电离程度越大
【答案】C
【解析】
A. 该离子为S2,硫离子属于弱离子,能发生水解,从而促进水电离,故A错误;
B. 酸或碱抑制水电离,含有弱离子的盐促进水电离,HCl在水溶液中能电离出氢离子而抑制水电离,故B错误;
C. 离子积常数只与温度有关,与溶液酸碱性无关,醋酸根离子水解而促进水电离,温度不变,水的离子积常数不变,故C正确;
D. 水的电离是吸热反应,升高温度促进水电离,所以温度越高,水的电离程度越大,酸或碱抑制水电离,含有弱离子的盐促进水电离,故D错误;
故选:C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目