题目内容
【题目】明矾[KAl(SO4)2·12H2O]和铵明矾[NH4Al(SO4)2·12H2O]都是限制使用的食品添加剂。
(1)KAl(SO4)2的电离方程式为_______________ KAl(SO4)2可作净水剂,其原因是(用必要的化学用语和相关文字说明)。
(2)已知几种电解质溶液的 pH随温度变化的曲线如图1所示。 其中符合KAl(SO4)2溶液的pH随温度变化的曲线是_______ (填罗马数字)。
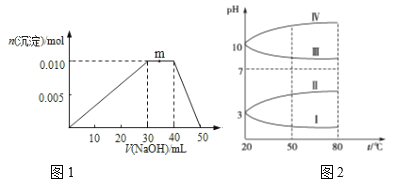
(3)向盛有100mL NH4Al(SO4)2溶液的烧杯中滴加NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意如图2所示。
①写出m点反应的离子方程___
②当加入45mL NaOH时,烧杯中Al元素的存在形式为 __________
③由图象可知所滴NaOH溶液的浓度为________________
【答案】KAl(SO4)2=K++Al3++2SO42- I NH4++OH-=NH3·H2O Al(OH)3和NaAlO2 1mol/L
【解析】
(1)KAl(SO4)2是离子化合物且易溶于水,再溶液中完全电离;Al3+水解生成的Al(OH)3具有吸附性。
(1)KAl(SO4)2是离子化合物,且易溶于水,再溶液中完全电离,其电离方程式为KAl(SO4)2=K++Al3++2SO42-;故答案为: KAl(SO4)2=K++Al3++2SO42 ;
(2) 因为Al3+水解生成的Al(OH)3,其离子方程式:Al3++3H2O═Al(OH)3+3H+,使溶液显酸性,因为水解为吸热反应,所有升高温度,促进水解,使溶液的酸性增强,故曲线I符合题意,答案为I。
生成的Al(OH)3吸附能力很强,可以吸附水里悬浮的杂质,并形成沉淀,使水澄清;
(3)①向盛有100mL NH4Al(SO4)2溶液的烧杯中滴加NaOH溶液,沉淀物质的量随NaOH溶液逐渐增大,当所有的Al3+完全反应后,再滴加氢氧化钠,和铵根离子反应,继续加入氢氧化钠,Al(OH)3又会溶解,所有,m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH反应生成NH3H2O,离子方程式为:NH4++OH=NH3H2O,故答案为:NH4++OH=NH3H2O;
②如图可知在氢氧化钠溶液滴加到40mL50mL时,氢氧化铝逐渐溶解,此时发生+ OH=AlO2-+ H2O,所以当加入45mL NaOH时,烧杯中Al元素的存在形式为Al(OH)3和NaAlO2;所以答案为:Al(OH)3和NaAlO2;
③由图可知,生成的Al(OH)3的物质的量为0.01mol,Al3++3OH=Al(OH)3↓,则氢氧化钠的物质的量为0.03mol,其体积为0.03L,所以NaOH溶液的浓度为1molL1,所有本题答案:1molL1。

 名校课堂系列答案
名校课堂系列答案