题目内容
【题目】化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )
选项 | 化学反应 | 测量依据(单位时间内) |
A | 2NO2 | 颜色深浅 |
B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
C | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |
【答案】C
【解析】
试题分析:化学反应速率用单位时间内反应物的浓度的减少或生成物浓度的增加量来表示;A.2NO2![]() N2O4,NO2是红棕色气体,N2O4是无色气体,可以用单位时间内气体颜色的变化来衡量反应的快慢,故A可行;B.单位时间内H2体积变化多,速率快,故B可行;C.该反应是体积不变的反应,反应前后压强始终不变,故C不可行;D.单位时间内产生的沉淀的质量越高,速率越快,故D可行;故选A。
N2O4,NO2是红棕色气体,N2O4是无色气体,可以用单位时间内气体颜色的变化来衡量反应的快慢,故A可行;B.单位时间内H2体积变化多,速率快,故B可行;C.该反应是体积不变的反应,反应前后压强始终不变,故C不可行;D.单位时间内产生的沉淀的质量越高,速率越快,故D可行;故选A。

【题目】已知以下信息:①1 mol N2的共价键断裂吸收946 kJ的能量;1 mol H2的共价键断裂吸收436 kJ的能量;形成1 mol NH3中的化学键释放1 173 kJ的能量。②将一定量的N2和H2投入一密闭容器中,在一定条件下进行反应,测得有关数据如下:
N2(mol·L-1) | H2(mol·L-1) | NH3(mol·L-1) | |
起始时 | 3 | 3 | 0 |
2s末 | 2.6 | 1.8 | 0.8 |
根据以上相关数据回答问题:
(1)用H2表示该反应2 s内的平均反应速率为________
(2)______(填“能”或“不能”)确认该反应2 s末已达化学平衡状态。
(3)写出该反应的化学方程式:
________________________________________________________________________。
(4)氮气和氢气生成氨气的过程______(填“释放”或“吸收”)能量。
【题目】Ⅰ.高纯度氢氧化镁广泛应用于医药、电力等领域。镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如图所示:
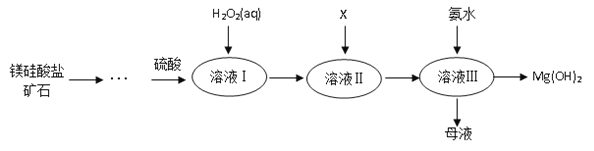
已知:
①溶液Ⅰ中除含Mg2+、SO42外,还含有少量Fe3+、Al3+、Fe2+等离子;
②常温下,几种金属离子开始沉淀和沉淀完全时的pH如下表所示:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
开始沉淀时的pH | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时的pH | 3.7 | 5.2 | 9.7 | 12.4 |
请回答下列问题:
(1)镁在元素周期表中的位置_______________;
(2)向溶液Ⅱ中加入试剂X是_____________,作用是_________________________;
(3)流程中不加H2O2引起的后果是___________________________________;
(4)说出母液的一种用途___________________;
(5)加入H2O2溶液发生反应的离子方程式是___________________;
Ⅱ.海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
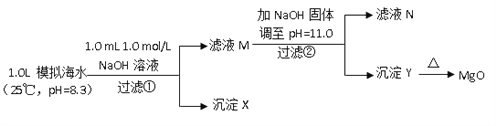
模拟海水中的离子浓度/ (mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;Ksp [Ca(OH)2]=4.68×10-6;Ksp [Mg(OH)2]=5.61×10-12。请回答下列问题:
(6)沉淀物X为_____________;
(7)滤液N中Ca2+浓度为_______________;
(8)加NaOH固体调整pH=12.5是否可行______(填“是”“否”);原因是________。
【题目】间溴苯甲醛(![]() ),是香料、染料、有机合成中间体,常温比较稳定,高温易被氧化。相关物质的沸点如下(101kPa)。
),是香料、染料、有机合成中间体,常温比较稳定,高温易被氧化。相关物质的沸点如下(101kPa)。
物质 | 沸点/℃ | 物质 | 沸点/℃ |
溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
苯甲醛 | 179 | 间溴苯甲醛 | 229 |
其实验室制备步骤如下:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水MgSO4固体,放置一段时间后过滤。
步骤4:减压蒸馏有机相,收集相应馏分。(实验装置见下图)

(1)仪器A的名称为___________________,1,2-二氯乙烷的电子式为__________;
(2)实验装置中冷凝管的主要作用是________,进水口为____(填“a”或“b”);
(3)步骤1反应方程式为____________________;为吸收尾气锥形瓶中的溶液应为________,反应的离子方程式为________________;
(4)水浴加热的优点是__________________________;
(5)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的______(填化学式);
(6)步骤4中采用减压蒸馏技术,是为了防止_______________。