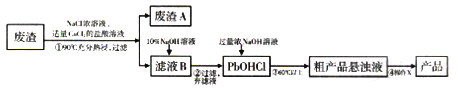
题目内容
【题目】Ⅰ.高纯度氢氧化镁广泛应用于医药、电力等领域。镁硅酸盐矿石可用于生产氢氧化镁,简要工艺流程如图所示:
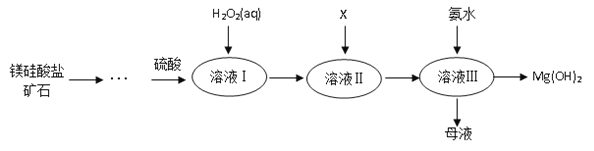
已知:
①溶液Ⅰ中除含Mg2+、SO42外,还含有少量Fe3+、Al3+、Fe2+等离子;
②常温下,几种金属离子开始沉淀和沉淀完全时的pH如下表所示:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ |
开始沉淀时的pH | 1.5 | 3.3 | 6.5 | 9.4 |
沉淀完全时的pH | 3.7 | 5.2 | 9.7 | 12.4 |
请回答下列问题:
(1)镁在元素周期表中的位置_______________;
(2)向溶液Ⅱ中加入试剂X是_____________,作用是_________________________;
(3)流程中不加H2O2引起的后果是___________________________________;
(4)说出母液的一种用途___________________;
(5)加入H2O2溶液发生反应的离子方程式是___________________;
Ⅱ.海水中含有丰富的镁资源。某同学设计了从模拟海水中制备MgO的实验方案:
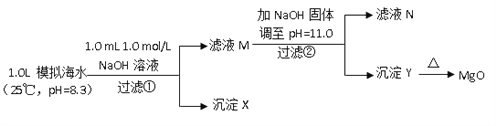
模拟海水中的离子浓度/ (mol/L) | Na+ | Mg2+ | Ca2+ | Cl- | HCO3- |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10-5mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变。
已知:Ksp(CaCO3)=4.96×10-9;Ksp(MgCO3)=6.82×10-6;Ksp [Ca(OH)2]=4.68×10-6;Ksp [Mg(OH)2]=5.61×10-12。请回答下列问题:
(6)沉淀物X为_____________;
(7)滤液N中Ca2+浓度为_______________;
(8)加NaOH固体调整pH=12.5是否可行______(填“是”“否”);原因是________。
【答案】 第三周期第ⅡA族 MgO或MgCO3、Mg(OH)2 既调节溶液的pH又不引入杂质 直接调pH小于9.4,Fe2+离子沉淀不完全,调pH大于9.7会使Mg2+损失 化肥 2Fe2++2H2O2+2H+=2Fe3++2H2O CaCO3 0.01mol/L 否 如果pH调制12.5会使氢氧化钙沉淀,会使产品不纯
【解析】Ⅰ.溶液Ⅰ中除MgSO4外,还含有少量Fe3+、Al3+、Fe2+等离子,根据题中提供的各种金属离子沉淀的pH值可知,加入双氧水可以将亚铁离子氧化成铁离子,再加入试剂X主要作用是调节溶液pH值,使铁离子沉淀,可以加氧化镁或氢氧化镁等,过滤后在滤液中加入氨水使溶液中镁离子沉淀,得氢氧化镁沉淀,由于要通过使铁离子沉淀的方法除去铁,所以要先氧化再沉淀;
(1)Mg的原子序数为12,原子核外有3个电子层,最外层电子数为2,则位于周期表第三周期ⅡA族;
(2)根据上面的分析可知,向溶液Ⅱ中加入X时不能引入新的杂质,同时要能与H+反应,则可加入 MgO或MgCO3、Mg(OH)2 ;X的作用是调节溶液pH又不引入杂质;
(3)流程中H2O2的作用是氧化Fe2+,便于与Mg2+分离,如不加H2O2引起的后果是直接调pH小于9.4,Fe2+离子沉淀不完全,调pH大于9.7会使Mg2+损失;
(4)母液中含有的溶质主要是(NH4)2SO4,可用作化肥;
(5)根据上面的分析可知,加入H2O2溶液反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O;
Ⅱ.步骤①,加入0.001molNaOH时,OH-恰好与HCO3-完全反应,生成0.001molCO32-.由于Ksp(CaCO3)<<Ksp(MgCO3),生成的CO32-与水中的Ca2+反应生成CaCO3沉淀,滤液M中同时存在着Ca2+和Mg2+;步骤②,当滤液M中加入NaOH固体,调至pH=11时,此时滤液中c(OH-)=1×10-3molL-1,根据溶度积可判断无Ca(OH)2生成,有Mg(OH)2沉淀生成;
(6)有分析可知沉淀物X为CaCO3;
(7)步骤②,当滤液M中加入NaOH固体,调至pH=11(即pOH=3)时,此时滤液中c(OH-)=1×10-3molL-1,则Q[Ca(OH)2]=c(Ca2+)×(10-3)2=0.010×(10-3)2=10-8<Ksp[Ca(OH)2],无Ca(OH)2生成;Q[Mg(OH)2]=c(Mg2+)×(10-3)2=0.050×(10-3)2=5×10-8>Ksp[Mg(OH)2],有Mg(OH)2沉淀生成;又由于Ksp[Mg(OH)2]=c(Mg2+)×(10-3)2=5.6×10-12,c(Mg2+)=5.6×10-6<10-5,无剩余,滤液N中不存在Mg2+,存在Ca2+,c(Ca2+)=0.01mol/L;
(8) 如果pH调制12.5会使氢氧化钙沉淀,会使产品不纯,故不可直接加NaOH固体调整pH=12.5。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】化学反应速率是通过实验测定的,下列化学反应速率的测量中,测量依据不可行的是( )
选项 | 化学反应 | 测量依据(单位时间内) |
A | 2NO2 | 颜色深浅 |
B | Zn+H2SO4=ZnSO4+H2 | H2体积 |
C | CO(g)+H2O(g)=CO2(g)+H2(g) | 压强变化 |
D | Ca(OH)2+Na2CO3=CaCO3↓+2NaOH | 沉淀质量 |