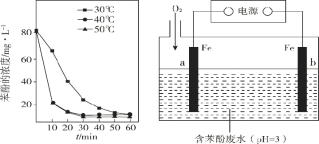
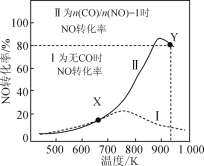
题目内容
【题目】X、Y、Z三种元素的原子序数依次减小且三者原子序数之和为16,其常见单质在适当条件下可发生如图所示变化,其中B和C均为10电子分子。下列说法不正确的是( )
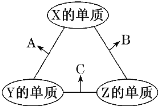
A.X元素位于VIA族B.1 molC中含有3mol共价键
C.A和C在一定条件下能发生氧化还原反应D.X与Y的最高正价大小:X>Y
【答案】D
【解析】
B和C均为10电子分子,考虑为氢化物,由转化关系可知,Z为氢,X、Y、Z原子序数之和为16,则X、Y的原子序数之和为15,原子序数X>Y,则Y为碳元素、X为氟元素或者Y为氮元素、X为氧元素,由转化关系,单质X、Y反应生成A,单质Y、Z生成B,则Y应为氮元素、X应为氧元素,则A为NO、B为H2O、C为NH3,验证符合转化关系。
A.X为氧,X元素位于VIA族,故A正确;
B.C为NH3,1 molC中含有3mol共价键,故B正确;
C.A为NO、C为NH3,A和C在一定条件下能发生氧化还原反应,6NO+4NH3![]() 5N2+6H2O,故C正确;
5N2+6H2O,故C正确;
D.Y应为氮元素最高+5价、X应为氧元素,一般不显正价,故D错误;
故选D。

 应用题作业本系列答案
应用题作业本系列答案【题目】表为元素周期表的一部分,请回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ |
(1)表中最活泼的金属是___________,非金属性最强的元素是____________。(填写元素符号,下同)
(2)表中能形成两性氢氧化物的元素是_______________,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物对应水化物反应的化学方程式:___________、___________。
(3)⑨最高价氧化物对应水化物的电子式______________。
(4)利用下图装置来验证同主族元素非金属性的变化规律:
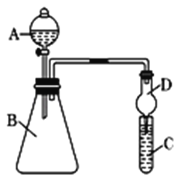
要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,应在B、D之间增加一个盛有足量____(选填下列字母:A 浓盐酸 、B 浓NaOH溶液、C 饱和Na2CO3溶液 、D 饱和NaHCO3溶液)的洗气装置.改进后C中发生反应的化学方程式是_____.
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)原子半径最小的元素是___(填元素名称),写出⑧的原子结构示意图____________。
(2)最高价氧化物对应的水化物中,碱性最强的是___(用化学式回答,下同),酸性最强的是____。
(3)①与⑤形成的化合物中,化学键类型为____。
(4)⑦与⑨形成的化合物的电子式为__,②与④形成的原子个数比为1:2的化合物的结构式为__。
(5)①与②形成的一种烃,具有平面正六边形结构,相对分子质量为78,写出此烃发生取代反应的化学方程式(任写一个即可):_。
(6)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:
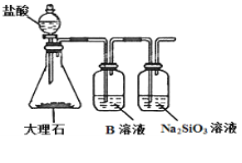
①溶液B为______,B溶液的作用是______。
②若看到_______现象,即可证明酸性_______(用化学式回答),则非金属性______(用元素符号回答)。