��Ŀ����
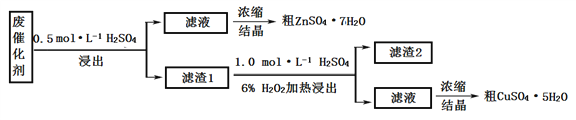
����Ŀ�����������䡢��ˮ��Ӧ,������ˮ������Ӧ��������ʾ���ڲ�ͬ�¶��£�������ˮ������Ӧ�IJ��ﲻͬ���¶ȵ���570 ��ʱ,����FeO������570 ��ʱ������Fe3O4��ijѧ������ͼ��ʾʵ��װ�ã���ɻ�ԭ������ˮ������Ӧ��ʵ�顣
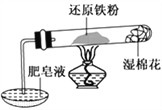
��1��ʵ����ʹ�÷���Һ��������___________________��
��2����ͬѧΪ̽��ʵ����Թ��ڵĹ��庬����Щ����,����������ʵ��:
ʵ���� | ʵ����� | ʵ������ |
�� | ȡ������ɫ��ĩX�����Թ�1�У���������,�� | ��ɫ��ĩ���ܽ⣬��Һ����ɫ�����������ݲ��� |
�� | ���Թ�1�еμӼ���KSCN��Һ���� | ��Һû�г��ֺ�ɫ |
��������ʵ��,��ȷ�������д��ڵ������У�______________________________������ȷ���Ƿ����Fe3O4��ԭ���ǣ�___________________________________________��
��3����ͬѧ�������ʵ�鷽����ȷ��ʵ����Թ��ڵĹ����Ƿ����Fe3O4��

����ҺX�з���������ԭ��Ӧ�����ӷ���ʽΪ___________��
�ڲ���aΪ_______����������Ƿ��Ѿ�ϴ�Ӹɾ��IJ�����___________________��
�����ȡ������Ʒm1�ˣ���Ӧ��õ�����ɫ����m2�ˣ���m1��m2֮������Ӧ����______ʱ������ȷ��������Ʒ��һ������Fe3O4��
��4����ͬѧ���Թ��ڹ��忴�����������FexO����ȡ��6.08g�������������У���������Һ��ͨ��448mLCl2����״������ǡ�ý�Fe2+��ȫ��������X=__________��
���𰸡� �ռ������鷴Ӧ�����ɵ�H2 Fe Fe3O4������������Fe3+,��Fe��Ӧ����Fe2+ 2Fe2++2H++H2O2=2Fe3++2H2O ���ˡ�ϴ�� ȡ�������һ��ϴ��Һ���μ�AgNO3��Һ�����������ɣ������������ϴ������֮δϴ���� 0.9 0.8
����������1��ʹ�÷���Һ�������Ǽ��鷴Ӧ�����ɵ�H2����Ӧһ��ʱ����з����ݴ���ʱ���õ�ȼ�Ļ�������ݣ�������������ʱ��˵��������ˮ�������ܹ����з�Ӧ����2����ɫ��ĩ���ܽ⣬��Һ����ɫ�����Թ�1�еμӼ���KSCN��Һ������Һû�г��ֺ�ɫ��˵���������������ɣ����������ݲ�����˵��һ���е�����������Fe3O4������������Fe3+����������Fe��Ӧ����Fe2+�����Բ���ȷ���Ƿ����Fe3O4����3����˫��ˮ�ɽ���������������Ϊ���������ӣ����ӷ���ʽΪ2Fe2++2H++H2O2=2Fe3++2H2O��������aΪ���ˡ�ϴ�ӣ�ϴ��Һ���������ӣ�����������ϴ�Ӹɾ������鷽��Ϊȡ�������һ��ϴ��Һ���μ�AgNO3��Һ�����������ɣ�����������ϴ�Ӹɾ�����֮δϴ�����۹�����Ʒm1�������ɫ����m2��������Ԫ�ص����ʵ�����ͬ������ȫ����FeO����
2FeO��Fe2O3
144g 160g
m1��m2֮��=144g/160g=0.9��
����ȫ����Fe3O4����
2Fe3O4��3Fe2O3
464g 480g
m1��m2֮��=464g/480g=0.97��m1��m2֮������Ӧ����0.9ʱ��������Ʒ��һ������Fe3O4����4�����������ʵ�����0.448L��22.4L/mol��0.02mol����Ӧ����Ԫ�ػ��ϼ����ߵ�+3�ۣ�����ݵ��ӵ�ʧ�غ��֪![]() �����X��0.8��
�����X��0.8��

 ��������ϵ�д�
��������ϵ�д� ��ӡ�Ļ���ʱ����ϵ�д�
��ӡ�Ļ���ʱ����ϵ�д� ��ѧ�����ϵ�д�
��ѧ�����ϵ�д�����Ŀ���Թ�ҵ������ɰ���÷�����þ��Ϊԭ����ȡMgSO4H2O�Ĺ�����ͼ��ʾ�� 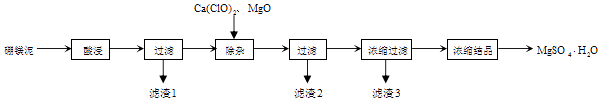
��þ�����Ҫ�ɷ������
MgO | SiO2 | FeO��Fe2O3 | CaO | Al2O3 | B2O3 |
30%��40% | 20%��25% | 5%��15% | 2%��3% | 1%��2% | 1%��2% |
���ϣ�B2O3����ˮ�γ����ᣬ��������������ˮ���ܽ�����¶ȵ����߶����ߣ�������þ��80���ܽ��������Գ��淽�����ѽ����߷��룬Ŀǰ�����ø��½ᾧ��
�ش��������⣺
��1��������1������Ҫ������д��ѧʽ��
��2��������2������Ҫ������д��ѧʽ�����жϡ����ӡ�������ɵļ��鷽����ȷ���� ��
A��ȡ�ϲ���Һ���μӱ�����Һ������ɫ
B��ȡ�ϲ���Һ���μ�KSCN�������
C��ȡ�ϲ���Һ���μ�K3[Fe��CN��6]��������ɫ����
��3������þ�������� �� ��ͬѧ��Ϊ��̼��þ��������þҪ�ã�ԭ���� ��
��4����������3Ӧ���ȹ��˵�ԭ���� �� ��������3���ĸҺ�к��е��������� �� ���Բ��ü�ѹ���ķ����õ�һˮ������þ��