题目内容
【题目】青铜(Cu-Zn)是我国最早大量使用的合金,其中锌是现代工业上常用金属。
I. 某废催化剂含58.2%的SiO2(不溶于水和稀酸)、21.0%的ZnO、4.5%的ZnS(不溶于水但溶于稀酸)和12.8%的CuS(不溶于水也不溶于稀酸)。某同学用15.0 g该废催化剂为原料,以稀硫酸和H2O2为试剂,回收其中的锌和铜。
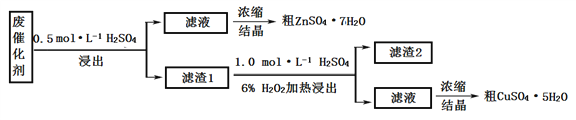
(1)浸出后的操作中,使用到的玻璃仪器有:烧杯、玻璃棒、__________________。
(2)滤渣2是______,第二次浸出发生的反应化学方程式是_________________________。
(3)两次结晶的操作是_________________________________________________________。
(4)某同学在实验完成之后,得到1.5gCuSO4·5H2O(M=250 g·mol–1),则铜的回收率为_______。
II.锌的化学性质与铝相似,锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(5)Al溶于NaOH溶液,反应的离子方程式为:_______________________________。
(6)Zn溶于NaOH溶液,反应的化学方程式为:_______________________________。
(7)下列各组中的两种溶液,用相互滴加的实验方法不可鉴别的是____________。
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
【答案】 漏斗 SiO2 CuS+4H2O2 =CuSO4+4H2O 加热浓缩冷却结晶过滤 30% 2Al+ 2OH﹣+2H2O= 2AlO2-+ 3H2↑或2Al+2NaOH+6H2O= 2Na[Al(OH)4]+ 3H2↑ Zn+2NaOH= Na2ZnO2+ H2↑或Zn+2NaOH+2H2O= Na2[Zn(OH)4]+ H2↑ ②
【解析】(1)浸出后的操作是过滤,使用到的玻璃仪器有:烧杯、玻璃棒、漏斗。(2)二氧化硅、CuS不溶于稀硫酸,则滤渣1是SiO2、CuS。加入硫酸酸化的双氧水氧化CuS生成硫酸铜,所以滤渣2是SiO2;第二次浸出发生的反应化学方程式是CuS+4H2O2=CuSO4+4H2O。(3)两次结晶的操作是加热浓缩冷却结晶过滤。(4)1.5gCuSO4·5H2O中铜的质量是![]() ,则铜的回收率为
,则铜的回收率为 。(5)Al溶于NaOH溶液生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH﹣+2H2O=2AlO2-+3H2↑。(6)根据铝与氢氧化钠溶液反应的方程式可知Zn与NaOH溶液反应的化学方程式为Zn+2NaOH=Na2ZnO2+H2↑。(7)①硫酸铝滴入氢氧化钠溶液中开始生成偏铝酸钠,氢氧化钠滴入硫酸铝溶液中立即产生白色沉淀,可以鉴别;②硫酸铝和氨水无论怎么滴加均产生白色沉淀,不能鉴别;③类似于硫酸铝与氢氧化钠,硫酸锌和氢氧化钠滴加顺序不同时实验现象不同,可以鉴别;④由于氢氧化锌能溶于氨水,生成Zn(NH3)42+,所以硫酸锌和氨水可以利用滴加顺序的不同进行鉴别,即硫酸锌滴入氨水中开始没有沉淀,而氨水滴入硫酸锌中立即产生沉淀,答案选②。
。(5)Al溶于NaOH溶液生成偏铝酸钠和氢气,反应的离子方程式为2Al+2OH﹣+2H2O=2AlO2-+3H2↑。(6)根据铝与氢氧化钠溶液反应的方程式可知Zn与NaOH溶液反应的化学方程式为Zn+2NaOH=Na2ZnO2+H2↑。(7)①硫酸铝滴入氢氧化钠溶液中开始生成偏铝酸钠,氢氧化钠滴入硫酸铝溶液中立即产生白色沉淀,可以鉴别;②硫酸铝和氨水无论怎么滴加均产生白色沉淀,不能鉴别;③类似于硫酸铝与氢氧化钠,硫酸锌和氢氧化钠滴加顺序不同时实验现象不同,可以鉴别;④由于氢氧化锌能溶于氨水,生成Zn(NH3)42+,所以硫酸锌和氨水可以利用滴加顺序的不同进行鉴别,即硫酸锌滴入氨水中开始没有沉淀,而氨水滴入硫酸锌中立即产生沉淀,答案选②。

【题目】已知原子序数,可能推断原子的
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数
⑥原子结构示意图 ⑦元素在周期表中的位置
A. ①②③④⑥ B. ①④⑤⑥⑦
C. ②③④⑤⑦ D. ③④⑤⑥⑦
【题目】铁不能与冷、热水反应,但能与水蒸气反应。资料显示,在不同温度下,铁粉与水蒸气反应的产物不同,温度低于570 ℃时,生成FeO,高于570 ℃时,生成Fe3O4。某学生用如图所示实验装置,完成还原铁粉与水蒸气反应的实验。
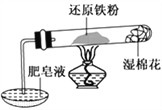
(1)实验中使用肥皂液的作用是___________________。
(2)甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈绿色;有少量气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据上述实验,能确定固体中存在的物质有:______________________________;不能确定是否存在Fe3O4的原因是:___________________________________________。
(3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4。

①溶液X中发生氧化还原反应的离子方程式为___________;
②操作a为_______,检验沉淀是否已经洗涤干净的操作是___________________。
③如果取固体样品m1克,反应后得到红棕色固体m2克,则m1与m2之比最少应大于______时,才能确定固体样品中一定存在Fe3O4。
(4)丙同学将试管内固体看做铁的氧化物(FexO),取出6.08g溶于足量盐酸中,向所得溶液中通入448mLCl2(标准状况),恰好将Fe2+完全氧化。则X=__________。