题目内容
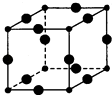
【题目】乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2 =CH2 + O2 → 2CH3CHO。下列有关说法正确的是( )
A.a电极发生还原反应
B.放电时,每转移2mol电子,理论上需要消耗28g乙烯
C.b极反应式为:O2+4e-+2H2O=4OH-
D.电子移动方向:电极a→磷酸溶液→电极b
【答案】B
【解析】A、a电极通入的是CH2=CH2 , CH2=CH2被氧化发生氧化原反应,A不符合题意;
B、由负极电极方程式为CH2=CH2-2e-+H2O=CH3CHO+2H+可知,每转移2mol电子,理论上需要消耗1mol,即28g乙烯,B符合题意;
C、正极发生还原反应,因为电解质溶液呈酸性,所以电极方程式为O2+4H++4e-═2H2O,C不符合题意;
D、电子只能经过导线,不能经过溶液,D不符合题意;
故答案为:BA.a电极通入乙烯,生成乙醛,发生氧化反应;
B.有电极反应式CH2=CH2-2e-+H2O=CH3CHO+2H+进行计算;
C.酸性介质中,正极反应应生成水;
D.电子只能在电极和导线间移动;

【题目】铁不能与冷、热水反应,但能与水蒸气反应。资料显示,在不同温度下,铁粉与水蒸气反应的产物不同,温度低于570 ℃时,生成FeO,高于570 ℃时,生成Fe3O4。某学生用如图所示实验装置,完成还原铁粉与水蒸气反应的实验。
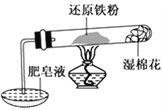
(1)实验中使用肥皂液的作用是___________________。
(2)甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈绿色;有少量气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据上述实验,能确定固体中存在的物质有:______________________________;不能确定是否存在Fe3O4的原因是:___________________________________________。
(3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4。
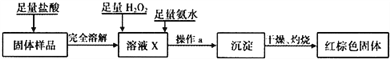
①溶液X中发生氧化还原反应的离子方程式为___________;
②操作a为_______,检验沉淀是否已经洗涤干净的操作是___________________。
③如果取固体样品m1克,反应后得到红棕色固体m2克,则m1与m2之比最少应大于______时,才能确定固体样品中一定存在Fe3O4。
(4)丙同学将试管内固体看做铁的氧化物(FexO),取出6.08g溶于足量盐酸中,向所得溶液中通入448mLCl2(标准状况),恰好将Fe2+完全氧化。则X=__________。