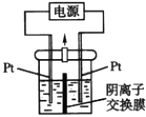
题目内容
【题目】以工业生产硼砂所得废渣硼镁泥为原料制取MgSO4H2O的过程如图所示: 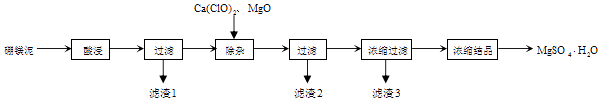
硼镁泥的主要成分如表:
MgO | SiO2 | FeO、Fe2O3 | CaO | Al2O3 | B2O3 |
30%~40% | 20%~25% | 5%~15% | 2%~3% | 1%~2% | 1%~2% |
资料:B2O3溶于水形成硼酸,由于硼酸易溶于水,溶解度随温度的升高而升高,而硫酸镁在80℃溶解度最大,所以常规方法很难将二者分离,目前常采用高温结晶法
回答下列问题:
(1)“滤渣1”中主要含有(写化学式)
(2)“滤渣2”中主要含有(写化学式),判断“除杂”基本完成的检验方法正确的是 .
A.取上层清液,滴加苯酚试液不显紫色
B.取上层清液,滴加KSCN,不变红
C.取上层清液,滴加K3[Fe(CN)6]不产生蓝色沉淀
(3)氧化镁的作用是 . 有同学认为用碳酸镁比用氧化镁要好,原因是 .
(4)分离滤渣3应趁热过滤的原因是 . 分离滤渣3后的母液中含有的溶质是和 , 可以采用加压、的方法得到一水合硫酸镁.
【答案】
(1)SiO2
(2)Fe(OH)3、Al(OH)3,AB
(3)调节pH,除去铝离子和铁离子,碳酸镁不仅可以调节pH,还可以除去钙离子
(4)防止硫酸镁结晶析出,提高产品产量,硼酸,硫酸镁,蒸发浓缩、趁热过滤
【解析】解:硼镁泥主要成份是MgO,还有CaO、Fe2O3、FeO、Al2O3、SiO2等杂质,酸溶时MgO、CaO、Fe2O3、FeO、Al2O3都和硫酸反应,SiO2不与硫酸反应,B2O3转化为H3BO3,则滤渣1为SiO2,次氯酸钙具有强氧化性,加入的次氯酸钙可把亚铁离子氧化成铁离子,MgO促进铁离子、铝离子水解,铁离子、铝离子转化为沉淀,则滤渣2为Al(OH)3、Fe(OH)3,浓缩过滤得到滤渣3为CaSO4,滤液中含镁离子、硫酸根离子,蒸发浓缩、冷却结晶得到硫酸镁晶体,以此来解答,
(1)“酸解”时应该加入的酸是浓硫酸,pH=1时B2O3转化为H3BO3,二氧化硅不反应,则“滤渣1”中主要含有SiO2,
所以答案是:SiO2;
(2)加入MgO促进铁离子、铝离子水解,铁离子、铝离子转化为沉淀,则滤渣2为Al(OH)3、Fe(OH)3,判断“除杂”基本完成的检验方法正确的是:
A.取上层清液,滴加苯酚试液不显紫色,说明不含铁离子,沉淀完全,故A正确;
B.取上层清液,滴加KSCN,不变红说明不含铁离子,沉淀完全,故B正确;
C.取上层清液,滴加K3[Fe(CN)6]不产生蓝色沉淀,说明不含亚铁离子,不能证明离子沉淀完全,故C错误;
所以答案是:Fe(OH)3、Al(OH)3,AB;
(3)加入MgO调节溶液pH,促进铁离子、铝离子水解,铁离子、铝离子转化为沉淀,用碳酸镁比用氧化镁要好的原因为碳酸镁不仅可以调节pH,还可以除去钙离子,
所以答案是:调节pH,除去铝离子和铁离子;碳酸镁不仅可以调节pH,还可以除去钙离子;
(4)分离滤渣3应趁热过滤的原因是温度对硫酸镁、硫酸钙的溶解度影响不同,温度越高,硫酸钙溶解度越小,硫酸镁在80℃左右溶解度最大所以该过程中温度应控制80℃左右,温度太低会析出晶体,所以要趁热过滤,分离滤渣3应趁热过滤的原因是;防止硫酸镁结晶析出,提高产品产量,分离滤渣3后的母液中含有的溶质是分离滤渣3后的母液中含有的溶质是,可以采用加压、蒸发浓缩、趁热过滤的方法得到一水合硫酸镁,
所以答案是:防止硫酸镁结晶析出,提高产品产量;硼酸和硫酸镁;蒸发浓缩、趁热过滤;

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案【题目】已知原子序数,可能推断原子的
①质子数 ②中子数 ③质量数 ④核电荷数 ⑤核外电子数
⑥原子结构示意图 ⑦元素在周期表中的位置
A. ①②③④⑥ B. ①④⑤⑥⑦
C. ②③④⑤⑦ D. ③④⑤⑥⑦
【题目】铁不能与冷、热水反应,但能与水蒸气反应。资料显示,在不同温度下,铁粉与水蒸气反应的产物不同,温度低于570 ℃时,生成FeO,高于570 ℃时,生成Fe3O4。某学生用如图所示实验装置,完成还原铁粉与水蒸气反应的实验。
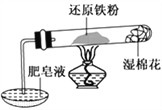
(1)实验中使用肥皂液的作用是___________________。
(2)甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管1中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈绿色;有少量气泡产生 |
② | 向试管1中滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
根据上述实验,能确定固体中存在的物质有:______________________________;不能确定是否存在Fe3O4的原因是:___________________________________________。
(3)乙同学设计下列实验方案以确定实验后试管内的固体是否存在Fe3O4。

①溶液X中发生氧化还原反应的离子方程式为___________;
②操作a为_______,检验沉淀是否已经洗涤干净的操作是___________________。
③如果取固体样品m1克,反应后得到红棕色固体m2克,则m1与m2之比最少应大于______时,才能确定固体样品中一定存在Fe3O4。
(4)丙同学将试管内固体看做铁的氧化物(FexO),取出6.08g溶于足量盐酸中,向所得溶液中通入448mLCl2(标准状况),恰好将Fe2+完全氧化。则X=__________。