题目内容
11.硝酸铜晶体[Cu(NO3)2•3H2O]可用于制造高纯度氧化铜等,工业上可用废铜的烧渣浸取液(含硫酸铜、硫酸锌、硫酸亚铁等)生产硝酸铜晶体,其生产过程如下: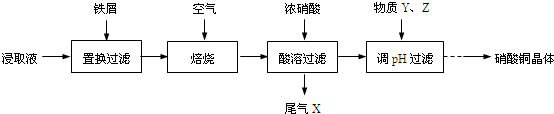
(1)置换过滤后滤液的主要成分是ZnSO4、FeSO4;焙烧的目的是减少硝酸的用量或氮氧化物的污染.
(2)焙烧产物之一FeO在酸溶过程中产生NO,离子方程式是3FeO+10H++NO3-═3Fe3++NO↑+5H2O.
(3)调pH过滤过程中,为保证充分氧化,先加物质Y为C;再加物质Z为B.
A.精制铁粉 B.精制氧化铜 C.双氧水 D.氯水 E.碳酸钠
(4)硝酸铜晶体热分解可得高纯度氧化铜,热分解过程中有红棕色气体产生.硝酸铜晶体热分解反应的化学方程式是(NO3)2•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑+6H2O.
分析 废铜的烧渣浸取液含CuSO4、ZnSO4、FeSO4等,向浸取液中加入铁屑,发生的离子反应有 Cu2++Fe=Fe2++Cu,然后过滤得到的固体含有Fe、Cu,将固体焙烧,Fe、Cu被氧化生成FeO和CuO,向溶液中加入浓硝酸,亚铁离子被氧化生成Fe3+,同时生成NO,向溶液中加入Y、Z并调节溶液的pH,然后过滤,将滤液蒸发浓缩、冷却结晶得到Cu(NO3)2•3H2O;
(1)向废液中加入铁屑时,只有铜离子和铁反应生成硫酸亚铁,硫酸锌不反应;将金属氧化为金属氧化物,能减少硝酸的用量并减少有害气体的产生;
(2)FeO和稀硝酸反应生成铁离子和NO;
(3)调pH过滤过程中,为保证充分氧化,需要反应时间较长,加入的物质有氧化性且不能引进新的杂质,最后加入物质反应剩余的酸,且不能引进杂质;
(4)硝酸铜晶体热分解可得高纯度氧化铜,热分解过程中有红棕色气体产生,说明有二氧化氮生成,此反应中N元素得电子,应该是O元素失电子生成氧气,根据反应物、生成物及反应条件书写方程式.
解答 解:废铜的烧渣浸取液含CuSO4、ZnSO4、FeSO4等,向浸取液中加入铁屑,发生的离子反应有 Cu2++Fe=Fe2++Cu,然后过滤得到的固体含有Fe、Cu,将固体焙烧,Fe、Cu被氧化生成FeO和CuO,向溶液中加入浓硝酸,亚铁离子被氧化生成Fe3+,同时生成NO,向溶液中加入Y、Z并调节溶液的pH,然后过滤,将滤液蒸发浓缩、冷却结晶得到Cu(NO3)2•3H2O;
(1)向废液中加入铁屑时,只有铜离子和铁反应生成硫酸亚铁,硫酸锌不反应,所以转换后滤液中溶质是ZnSO4、FeSO4;将金属氧化为金属氧化物,能减少硝酸的用量并减少有害气体的产生,所以焙烧的目的是减少硝酸的用量或氮氧化物的污染,
故答案为:ZnSO4、FeSO4;减少硝酸的用量或氮氧化物的污染;
(2)FeO和稀硝酸反应生成铁离子和NO,离子方程式为3FeO+10H++NO3-═3Fe3++NO↑+5H2O,
故答案为:3FeO+10H++NO3-═3Fe3++NO↑+5H2O;
(3)调pH过滤过程中,为保证充分氧化,需要反应时间较长,加入的物质有氧化性且不能引进新的杂质,所以Y为双氧水,最后加入物质反应剩余的酸,且不能引进杂质,Z为CuO,
故答案为:C;B;
(4)硝酸铜晶体热分解可得高纯度氧化铜,热分解过程中有红棕色气体产生,说明有二氧化氮生成,此反应中N元素得电子,应该是O元素失电子生成氧气,结合元素守恒知还生成水,根据反应物、生成物及反应条件书写方程式为:(NO3)2•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑+6H2O,
故答案为:(NO3)2•3H2O$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑+6H2O.
点评 本题以物质制备为载体考查物质的分离提纯,为高频考点,侧重考查元素化合物知识、氧化还原反应、基本操作等,综合性较强,明确元素化合物性质及基本反应原理、基本操作即可解答,熟悉流程图中发生的反应及分离方法,难点是(3)题加入的物质名称及先后顺序,题目难度不大.


| A. | M:MaOH X:CO2 | B. | M:HNO3 X:Fe | C. | M:S X:O2 | D. | M:Al X:NaOH |
⑦红褐色的氢氧化铁液体; ⑧氨水;⑨稀硝酸;⑩Al2(SO4)3
上述各物质按物质的分类方法填写表格的空白处(填物质编号):
| 分类标准 | 金属单质 | 酸性氧化物 | 碱性氧化物 | 溶液 | 胶体 | 电解质 |
| 属于该类的物质 |
(3)⑩在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-.
(4)少量的④通入⑥的溶液中反应的离子方程式为Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)②与⑨发生反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,该反应的氧化剂是HNO3(填化学式),氧化剂与还原剂的物质的量之比是2:3,当有3.2g Cu发生反应时,转移电子的物质的量为0.1mol.该反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
| AgCl | Agl | Ag2S | |
| KSP(单位省略) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
| A. | 沉淀转化的实质就是沉淀溶解平衡的移动 | |
| B. | 溶解度小的沉淀可以转化为溶解度更小的沉淀 | |
| C. | AgCl固体在等物质的量浓度的NaCl、CaCl2 溶液中的溶解度相同 | |
| D. | 25℃时,在饱和AgCl、Agl、Ag2S溶液中,所含Ag+的浓度相同 |
| A. | 一氯甲烷的结构式CH3Cl | B. | 苯的分子式C6H6 | ||
| C. | 葡萄糖的结构简式C6H12O6 | D. | 氮气的电子式 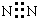 |
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 组成单质的分子内一定含有共价键 | |
| C. | 由非金属元素组成的化合物不一定是共价化合物 | |
| D. | 不同元素组成的多原子分子里的化学键一定为极性键 |
| A. | 常温pH=11的烧碱溶液与pH=3的稀醋酸等体积混合后,滴入石蕊试液呈红色 | |
| B. | T℃时,pH=6的纯水中,含10-8NA个OH-(NA表示阿伏加德罗常数) | |
| C. | 将NaAlO2、FeCl3、Al2(SO4)3的水溶液分别在蒸发皿中加热、蒸干并灼烧,都能得原溶质 | |
| D. | 常温下由水电离的c(H+)=1×10-13mol/L的溶液里,能大量存在NH4+、Fe2+、NO3- |
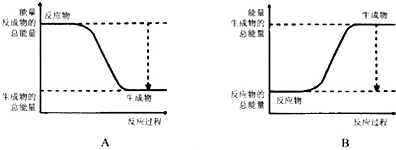 根据化学反应与能量转化的相关知识,试回答下列问题:
根据化学反应与能量转化的相关知识,试回答下列问题: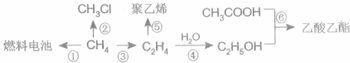
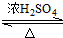 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;