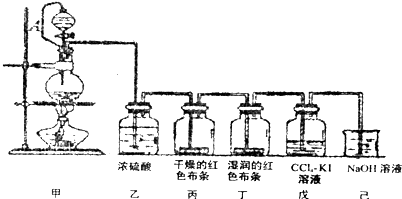
题目内容
8. Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题:
Ⅰ.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题: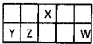
(1)写出X的原子结构示意图
 .
.(2)Y、Z、W的简单离子半径由大到小顺序为S2->Cl->Al3+(用离子符号表示).
(3)含Y的某种盐常用作净水剂,其净水原理是Al3+3H2O?Al(OH)3(胶体)+3H+(用离子方程式表示).
Ⅱ.运用所学化学原理,解决下列问题:
(4)已知:①C(s)+O2(g)═CO2(g);△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g);△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s);△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=2CO(g)+Si(s)△H=(a+b-c)kJ•mol-1.
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
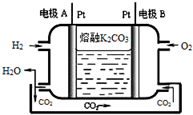
(6)以熔融K2CO3为电解质的一种新型氢氧燃料电池工作原理如图所示.写出电极A的电极反应式H2-2e-+CO32-═CO2+H2O.
分析 Ⅰ.由短周期元素X、Y、Z、W在周期表中相对位置可知,X处于第二周期,其余元素处于第三周期,其中Y所处的周期序数与族序数相等,处于ⅢA族,则Y为Al、Z为Si、X为N、W为Cl,据此解答;
Ⅱ.(4)根据盖斯定律书写目标热化学方程式;
(5)由表中数据可知,升高温度,平衡常数减小,平衡向逆反应方向移动,正反应为放热反应;
CO和H2O起始浓度相等,令他们的浓度为1mol/L,设平衡时CO的浓度变化量为xmol/L,利用三段式表示出平衡时各组分的浓度,根据平衡常数列方程计算,进而计算CO转化率;
(6)A为负极氢气发生氧化反应,生成的氢离子与电解质溶液中的碳酸根离子结合生成二氧化碳和水,电极反应式为:H2-2e-+CO32-═CO2+H2O.
解答 解:Ⅰ.由短周期元素X、Y、Z、W在周期表中相对位置可知,X处于第二周期,其余元素处于第三周期,其中Y所处的周期序数与族序数相等,处于ⅢA族,则Y为Al、Z为Si、X为N、W为Cl,
(1)X为N元素,原子结构示意图为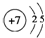 ,故答案为:
,故答案为: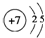 ;
;
(2)电子层数越多半径越大,电子层数相同时,核电荷数越多半径越小,所以Y、Z、W的简单离子半径由大到小顺序为:S2->Cl->Al3+,故答案为:S2->Cl->Al3+;
(3)含铝盐溶液中铝离子水解得到氢氧化铝胶体,可以用作净水剂,净水原理离子方程式为:Al3+3H2O?Al(OH)3(胶体)+3H+,
故答案为:Al3+3H2O?Al(OH)3(胶体)+3H+;
Ⅱ.(4)已知:①C(s)+O2(g)═CO2(g)△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g)△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s)△H=c kJ•mol-1,
根据盖斯定律,①+②-③得:2C(s)+SiO2(s)=2CO(g)+Si(s)△H=(a+b-c) kJ•mol-1,
故答案为:2C(s)+SiO2(s)=2CO(g)+Si(s)△H=(a+b-c) kJ•mol-1;
(5)由表中数据可知,升高温度,平衡常数减小,平衡向逆反应方向移动,正反应为放热反应,即△H<0;
CO和H2O起始浓度相等,令他们的起始浓度为1mol/L,设平衡时CO的浓度变化量为xmol/L,则:
CO(g)+H2O(g)═H2(g)+CO2(g)
开始(mol/L):1 1 0 0
转化(mol/L):x x x x
平衡(mol/L):1-x 1-x x x
故$\frac{x•x}{(1-x)•(1-x)}$=9,解得x=0.75,
故CO的转化率=$\frac{0.75mol/L}{1mol/L}$×100%=75%,
故答案为:<;75%;
(6)A为负极氢气发生氧化反应,生成的氢离子与电解质溶液中的碳酸根离子结合生成二氧化碳和水,电极反应式为:H2-2e-+CO32-═CO2+H2O,故答案为:H2-2e-+CO32-═CO2+H2O.
点评 本题考查结构性质位置关系应用、原电池、热化学方程式、化学平衡计算等,侧重对基础知识的巩固,(5)注意三行式在解题中的综合应用,难度不大.

 每课必练系列答案
每课必练系列答案| A. | 食物储存在冰箱里 | |
| B. | 铁制品表面刷油漆 | |
| C. | 用5%H2SO4溶液代替25%H2SO4溶液与锌粒反应 | |
| D. | 用过氧化氢溶液制氧气时添加少量二氧化锰粉末 |
| 实验操作 | 实验目的 | |
| A | 将卤代烃加入到热NaOH溶液中一段时间后,取上层液体,加入AgNO3液产生沉淀 | 证明卤代烃中含有卤元素 |
| B | 向丙烯醛(CH2=CH-CHO)中加入足量新制银氨溶液后,滴入KMnO4(H+)溶液,观察紫色褪去 | 证明结构中存在碳碳双键 |
| C | 淀粉在硫酸催化作用下水解,将新制氢氧化铜悬浊液加入到水解后的溶液中 | 检验淀粉水解的产物葡萄糖 |
| D | 向纯碱中滴加醋酸,将产生的气体先通入饱和碳酸氢钠溶液再通入苯酚钠浓溶液 | 证明酸性:醋酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列判断正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列判断正确的是( )| A. | W的氢化物沸点高于水的沸点 | |
| B. | Q与氢形成的化合物一定含极性键,可能含有非极性键 | |
| C. | R的最高正价氧化物的水化物是弱电解质 | |
| D. | T与W的化合物可通过T、W的简单离子的水溶液混合制取 |
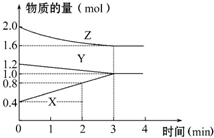 某温度时,在容积为3L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
某温度时,在容积为3L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,由图中数据分析:
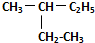 和
和 .
.