题目内容
9.下列图示的装置不属于原电池的是( )| A. |  | B. |  | C. |  | D. |  |
分析 根据原电池的构成条件分析,原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
解答 解:A、两电极材料不同,铁较活泼,能与硫酸自发的进行氧化还原反应,形成闭合回路,所以能形成原电池,故A不选;
B、两电极材料不同,锌较活泼,能与硫酸自发的进行氧化还原反应,形成闭合回路,所以能形成原电池,故B不选;
C、金属银和铜都不能与稀硫酸发生自发的氧化还原反应,所以不能形成原电池,故C选.
D、两电极材料不同,铝较活泼,能与硫酸自发的进行氧化还原反应,形成闭合回路,所以能形成原电池,故D不选;
故选C.
点评 本题考查了原电池的构成条件,难度不大,注意这几个条件必须同时存在才能形成原电池,缺一不可.

练习册系列答案
相关题目
19.原电池产生电流的本质原因是( )
| A. | 原电池溶液中电解质能电离出自由移动的离子 | |
| B. | 有导线将两个活动性不同的电极连接 | |
| C. | 正极发生了氧化反应,负极发生了还原反应 | |
| D. | 电极上进行的氧化还原反应中有电子的转移 |
20.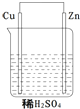 关于如图所示的原电池下列叙述正确的是( )
关于如图所示的原电池下列叙述正确的是( )
①电子由铜流向锌
②正极反应式为Cu+2e-=Cu2+
③SO42-向铜极移动
④铜电极上有气泡
⑤若有0.5mole-流经导线,则可产生0.25molH2
⑥烧杯中溶液的PH升高.
 关于如图所示的原电池下列叙述正确的是( )
关于如图所示的原电池下列叙述正确的是( )①电子由铜流向锌
②正极反应式为Cu+2e-=Cu2+
③SO42-向铜极移动
④铜电极上有气泡
⑤若有0.5mole-流经导线,则可产生0.25molH2
⑥烧杯中溶液的PH升高.
| A. | ①②③ | B. | ④⑤⑥ | C. | ①③⑤ | D. | ②④⑥ |
17.橙花醇具有玫瑰及苹果香气,可作为香料,其结构简式如下:

下列关于橙花醇的叙述,错误的是( )

下列关于橙花醇的叙述,错误的是( )
| A. | 既能发生取代反应,也能发生加成反应 | |
| B. | 在浓硫酸催化下加热脱水,可以生成不止一种四烯烃 | |
| C. | 1mol橙花醇与浓氢溴酸反应,最多消耗3mol HBr | |
| D. | 1mol橙花醇在室温下与溴的四氯化碳溶液反应,最多消耗 480g Br2 |
4.某恒温密闭容器中,可逆反应A(s)?B(?)+C(g)△H=+a kJ/mol达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )
| A. | 产物B的状态只能为固态或液态 | |
| B. | 平衡时,单位时间内c(A)消耗﹕c(C)消耗=1﹕1 | |
| C. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| D. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量a kJ |
14.下列说法正确的是( )
| A. | 冰熔化时,分子中H-O键发生断裂 | |
| B. | HI比HF易分解,是因为HI分子间不存在氢键 | |
| C. | 非极性键不可能存在于离子化合物中,由非金属元素组成的化合物中一定不存在离子键 | |
| D. | 含有阴离子的物质一定含有阳离子 |
1.化学与生产、生活、社会密切相关,下列说法正确的是( )
| A. | 明矾[KAl(SO4)2•12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 | |
| B. | 煤燃烧时加入少量的生石灰可以减少废气中二氧化硫排放 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 聚氟乙烯是纯净物 |
19.下列各组化合物中化学键类型不同的是( )
| A. | H2O和NH3 | B. | CCl4和H2O2 | C. | CaO和KCl | D. | NaCl和HCl |