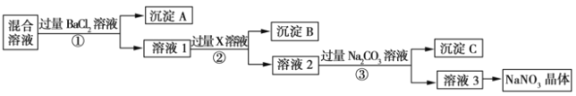
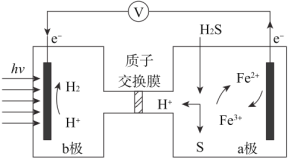
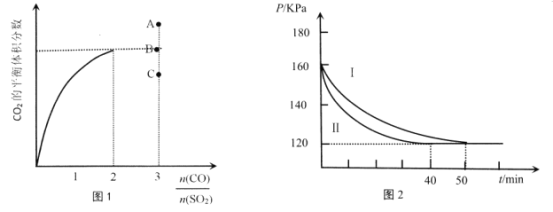
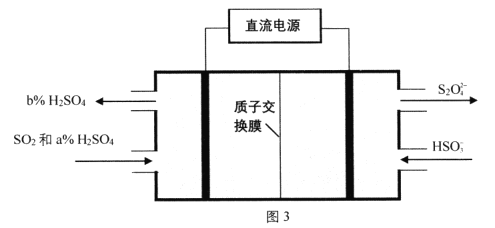
题目内容
【题目】中国海军航母建设正在有计划、有步骤向前推进,第一艘国产航母目前正在进行海试。建造航母需要大量的新型材料。航母的龙骨要耐冲击,航母的甲板要耐高温,航母的外壳要耐腐蚀。
(1)镍铬钢抗腐蚀性能强,Ni2+基态原子的核外电子排布为_______,铬元素在周期表中______区。
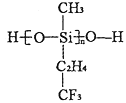
(2)航母甲板涂有一层耐高温的材料聚硅氧烷结构如图所示,其中C原子杂化方式为_______杂化。
(3)海洋是元素的摇篮,海水中含有大量卤族元素。
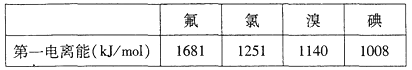
①根据下表数据判断:最有可能生成较稳定的单核阳离子的卤素原子是______填元素符号
②根据价层电子对互斥理论,预测ClO3-的空间构型为______形,写出一个ClO3-的等电子体的化学符号______。
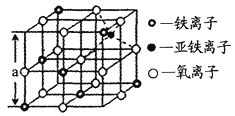
(4)海底金属软泥是在洋海底覆盖着的一层红棕色沉积物,蕴藏着大量的资源,含有硅、铁、锰、锌等。如右图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则晶体中的离子是否构成了面心立方最密堆积?_____(填“是”或“否”);该立方体是不是Fe3O4的晶胞?______(填“是”或“否”);立方体中铁离子处于氧离子围成的_______(填空间结构)空隙;根据下图计算Fe3O4晶体的密度为________g/cm3。(图中a=0.42nm,计算结果保留两位有效数字)
【答案】1s22s22p63s23p63d8 d sp3 Ⅰ 三角锥 SO32- 是 是 正八面体 5.2
【解析】
(1)Ni处于周期表中第四周期第ⅤⅢ族,是d区金属元素;
(2)聚硅氧烷中C形成4个单键;
(3)①根据第一电离能分析,第一电离能越小,越容易生成较稳定的单核阳离子;
②根据VSEPR理论判断ClO3-的空间构型,价电子对数为VP=BP+LP,等电子体是指原子总数相同,价电子总数也相同的微粒;
(4)根据O2-的坐标分析,根据晶胞粒子的排布,该立方体不是Fe3O4的晶胞,立方体中Fe3+处于O2-围成的正八面体空隙,根据密度公式ρ=![]() 计算。
计算。
(1)Ni处于周期表中第四周期第ⅤⅢ族,Ni2+基态原子的核外电子排布为1s22s22p63s23p63d8,铬元素在周期表中d区;
(2)聚硅氧烷中C形成4个单键,所以C的杂化方式为sp3;
(3)①根据第一电离能分析,第一电离能越小,越容易生成较稳定的单核阳离子,所以有可能生成较稳定的单核阳离子的卤素原子是I原子;
②根据VSEPR理论判断ClO3-的空间构型,价电子对数为VP=BP+LP=3+![]() =4,VSEPR模型为四面体形,由于一对孤电子对占据四面体的一个顶点,所以其空间构型为三角锥形,等电子体是指原子总数相同,价电子总数也相同的微粒,则与ClO3-互为等电子体的是SO32-;
=4,VSEPR模型为四面体形,由于一对孤电子对占据四面体的一个顶点,所以其空间构型为三角锥形,等电子体是指原子总数相同,价电子总数也相同的微粒,则与ClO3-互为等电子体的是SO32-;
(4)晶胞中,O2-的坐标为(![]() ,0,0),(0,
,0,0),(0,![]() ,0),(0,0,
,0),(0,0,![]() ),(
),(![]() ,
,![]() ,
,![]() ),将(
),将(![]() ,
,![]() ,
,![]() )+(
)+(![]() ,
,![]() ,0)=(0,0,
,0)=(0,0,![]() ),将(
),将(![]() ,
,![]() ,
,![]() )+(0,
)+(0,![]() ,
,![]() )=(
)=(![]() ,0,0),将(
,0,0),将(![]() ,
,![]() ,
,![]() )+(
)+(![]() ,0,
,0,![]() )=(0,
)=(0,![]() ,0),刚好与前三个坐标相同,所以O2-作面心立方最密堆积,根据晶胞粒子的排布,该立方体是Fe3O4的晶胞,立方体中Fe3+处于O2-围成的正八面体空隙,以立方体计算,1个立方体中含有Fe3+的个数为4×
,0),刚好与前三个坐标相同,所以O2-作面心立方最密堆积,根据晶胞粒子的排布,该立方体是Fe3O4的晶胞,立方体中Fe3+处于O2-围成的正八面体空隙,以立方体计算,1个立方体中含有Fe3+的个数为4×![]() +
+![]() ×3=2个,含有Fe2+的个数为1个,含有O2-的个数为12×
×3=2个,含有Fe2+的个数为1个,含有O2-的个数为12×![]() +1=4个,假设取1mol这样的立方体,即有NA个这样的立方体,1mol立方体的质量为m=(56×3+16×4)g,1个立方体体积为V=a3nm3=a3(a×10-7)3cm3,则晶体密度为ρ=
+1=4个,假设取1mol这样的立方体,即有NA个这样的立方体,1mol立方体的质量为m=(56×3+16×4)g,1个立方体体积为V=a3nm3=a3(a×10-7)3cm3,则晶体密度为ρ=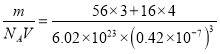 g/cm3=5.2 g/cm3。
g/cm3=5.2 g/cm3。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案