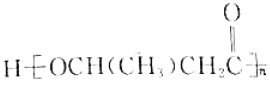题目内容
【题目】现有NaCl、Na2SO4.和NaNO3的混合物,选择适当的试剂除去杂质,从而得到纯净的NaNO3晶体,相应的实验流程如图所示。
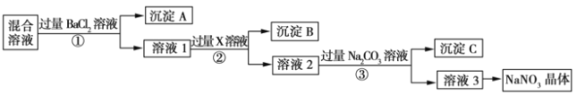
请回答下列问题:
(1)产生沉淀A的离子反应方程式是:________________________;
(2)试剂X是:____________________________________;
(3)上述实验流程中①②③步骤中均要用到的主要玻璃仪器有____________;
(4)上述实验流程中加入过量Na2CO3溶液产生的沉淀C是:________________________。
(5)按此实验方案得到的溶液3中肯定含有杂质,为了解决这个问题,可以向溶液3中加入适量的____________ (填化学式),并写出离子反应方程式:_______________________________________________。
(6)溶液3到硝酸钠晶体需要的操作步骤是:________________________洗涤,干燥。
【答案】Ba2++SO42-=BaSO4↓ AgNO3 烧杯、玻璃棒和三角漏斗 Ag2CO3和BaCO3 HNO3 CO32-+H+=H2O+CO2↑ 蒸发浓缩、冷却结晶、再过滤
【解析】
由流程可知,①中加氯化钡,硫酸根离子转化为沉淀,则沉淀A为BaSO4,溶液1中含氯化钠、硝酸钠、氯化钡,②中加AgNO3后氯离子转化沉淀,沉淀B为AgCl,溶液2中含硝酸钠、硝酸银、硝酸钡,③中钡离子,银离子转化为沉淀,沉淀C为碳酸钡、碳酸银,溶液3为硝酸钠和碳酸钠,转化中试剂过量保证离子完全转化为沉淀,以此来解答。
由流程可知,①中加氯化钡,硫酸根离子转化为沉淀,则沉淀A为BaSO4,溶液1中含氯化钠、硝酸钠、氯化钡,②中加AgNO3后氯离子转化沉淀,沉淀B为AgCl,溶液2中含硝酸钠、硝酸银、硝酸钡,③中钡离子,银离子转化为沉淀,沉淀C为碳酸钡、碳酸银,溶液3为硝酸钠和碳酸钠;
(1) 沉淀A为BaSO4,产生沉淀A的离子反应方程式是Ba2++SO42-=BaSO4↓;
(2) 由上述分析可知,X为AgNO3;
(3)流程中①②③步均生成沉淀,需要进行过滤操作,均要用到的主要玻璃仪器有烧杯、玻璃棒和三角漏斗;
(4) 加入过量的Na2CO3的目的是使溶液中的Ag+、Ba2+完全沉淀,则产生的沉淀C是Ag2CO3和BaCO3;
(5) 流程③滴加过量碳酸钠溶液,则过滤后的溶液3中肯定含有Na2CO3,可加适量的稀HNO3除去,发生反应的离子方程式为CO32-+H+=H2O+CO2↑;
(6)由于硝酸钠受热易分解,所以溶液3中滴加适量的稀硝酸后,经蒸发浓缩、冷却结晶、再过滤、洗涤、干燥即可得到纯净的硝酸钠。

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案【题目】PbCO3可用于油漆、陶瓷和玻璃等工业。由方铅矿(主要成分为PbS,含有杂质FeS等)和软锰矿(主要成分为MnO2)制备PbCO3的流程如下:
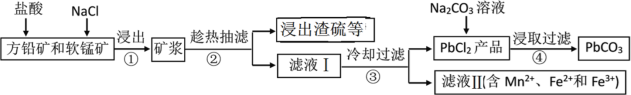
已知:PbCl2难溶于冷水和乙醇,易溶于热水;各物质的溶度积见表。试回答下列问题:
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | PbCl2 | PbS | PbCO3 |
Ksp | 2×10-13 | 8.0×10-16 | 1×10-38 | 1.6×10-5 | 8.0×10-28 | 7.4×10-14 |
(1)PbCO3的名称是________。
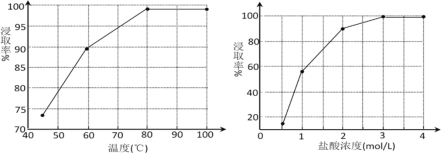
(2)步骤①中MnO2的作用是________,根据下图分析过程①的最佳反应条件是_________。
(3)步骤②趁热抽滤的原因是___________________。
(4)步骤③洗涤用的试剂是____________。
(5)将滤液Ⅱ先酸化,然后加入MnO2,反应的离子方程式为________;若反应后![]() ,进一步调节溶液的pH可分离出Fe3+和Mn2+,则调节溶液pH的范围为_________
,进一步调节溶液的pH可分离出Fe3+和Mn2+,则调节溶液pH的范围为_________![]() 时表示Fe3+已沉淀完全]。
时表示Fe3+已沉淀完全]。
(6)步骤④反应的离子方程式为______________。