题目内容
1.下列有关实验操作或结果正确的是( )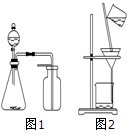
| A. | 选择合适试剂,用图1装置分别制取CO2、NO和O2 | |
| B. | 制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸 | |
| C. | 洗涤沉淀时(图2),向漏斗中加适量水,搅拌并滤干 | |
| D. | 用pH试纸测得0.10 mol•L-1NaF溶液的pH=5.2 |
分析 A.图1为排空法收集气体,NO与氧气反应;
B.制备乙酸乙酯时,加入药品时应防止酸液飞溅;
C.洗涤沉淀不能用玻璃棒搅拌;
D.NaF为强碱弱酸盐,水解呈碱性.
解答 解:A.NO与氧气反应,不能用排空法收集,只能用排水法,故A错误;
B.制备乙酸乙酯,加入药品时为应防止酸液飞溅,可先加入乙醇,再加入浓硫酸,冷却后再加入醋酸,故B正确;
C.为防止滤纸破损,洗涤沉淀不能用玻璃棒搅拌,故C错误;
D.NaF为强碱弱酸盐,水解呈碱性,pH大于7,故D错误.
故选B.
点评 本题考查较为综合,涉及气体的收集、乙酸乙酯的制备、过滤以及盐类的水解等知识,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握实验的严密性、可行性的评价,难度不大.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
11.下列各组离子能在pH=1的无色溶液中大量共存的是( )
| A. | Mg2+、Cl-、Na+、SO42- | B. | Ba2+、Na+、NO3-、MnO4- | ||
| C. | K+、Cl-、HCO3-、NO3- | D. | Ca2+、Na+、Fe3+、CO32 |
12.下列说法正确的是( )
| A. | 我国流通的硬币材质是金属单质 | |
| B. | 所有的不锈钢都只含有金属元素 | |
| C. | 黄铜的熔点高于金属铜,故应用广泛 | |
| D. | 镁合金的硬度和机械强度均高于纯镁 |
9.下列实验所采取的方法正确的是( )
| A. | 除去苯中苯酚,加入溴水后过滤 | |
| B. | 乙醛中含乙酸杂质,加入氢氧化钠溶液洗涤,分液 | |
| C. | 除去乙酸乙酯中乙酸,加入饱和NaOH溶液,振荡静置后分液 | |
| D. | 区别乙酸、乙醛、乙醇,加入新制的Cu(OH)2悬浊液加热 |
6.关于硅及其化合物的叙述中,不正确的是( )
| A. | 水玻璃可作粘合剂及耐火材料 | B. | 硅可做半导体材料 | ||
| C. | 二氧化硅是光导纤维的原料 | D. | 氮化硅陶瓷是做电子元件的材料 |
13.关于如图所示装置的叙述正确的是( )
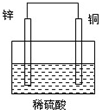

| A. | 氢离子在铜片表面被还原 | B. | 铜片质量逐渐减少 | ||
| C. | 电流从锌片经导线流向铜片 | D. | 溶液中阳离子移向锌片 |
11.F2和Xe在一定条件下可生成氧化性极强且极易水解的XeF2、XeF4和XeF6三种化合物.如XeF4与水可发生如下反应:6XeF4+12H2O═2XeO3+4Xe↑+24HF+3O2↑.下列判断中正确的是( )
| A. | XeF2分子中各原子均达到8电子稳定结构 | |
| B. | 上述反应中氧化产物和还原产物的物质的量之比为5:4 | |
| C. | 上述反应中氧化剂和还原剂的物质的量之比为2:1 | |
| D. | XeF4按上述方式水解,每生成4molXe,转移12mol电子 |
 铁和铁的化合物用途广泛.请回答下列问题:
铁和铁的化合物用途广泛.请回答下列问题: