题目内容
12.下列关于能源的描述正确的是( )| A. | “煤的液化”是指将煤加热变为液态 | |
| B. | “乙醇汽油”是为了增大燃烧的热值,在汽油中加入乙醇 | |
| C. | 光伏发电要用到铟,该元素是一种副族的金属元素 | |
| D. | 将燃料的燃烧反应设计为原电池,可以提高能量的利用率 |
分析 A、煤的液化是使煤与氢气作用生成液体燃料;
B、在汽油中加入乙醇,乙醇燃烧生成二氧化碳和水,所以加乙醇是减少污染;
C、铟是第五周期第ⅢA元素;
D、化学能转化为电能,能量转换率高,有利于节约能源.
解答 解:A.煤的液化是使煤与氢气作用生成甲醇、乙醇等其液态物质的过程,故A错误;
B、在汽油中加入乙醇,乙醇燃烧生成二氧化碳和水,所以加乙醇是减少污染,主要目的不是提高热值,故B错误;
C、铟是第五周期第ⅢA元素,是主族元素,而不是副族,故C错误;
D、化学能转化为电能,能量转换率高,有利于节约能源,所以将燃料的燃烧反应设计为原电池,可以提高能量的利用率,故D正确;
故选D.
点评 本题考查煤的液化、乙醇汽油、铟在周期表中的位置和能量的转化,综合性强,但比较容易.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
8.下列反应的离子方程式中正确的是( )
| A. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O | |
| B. | 硫酸铝溶液与过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 苯酚钠的水溶液中通入少量的CO2:2C6H5O?+CO2+H2O→2C6H5OH+CO32- | |
| D. | 醋酸钠的水解反应:CH3COO-+H3O+=CH3COOH+H2O |
3.在HNO2溶液中存在如下平衡:HNO2?H++NO2-,向该溶液中加入少量的下列物质后,能使电离平衡向右移动且使H+增多的是( )
| A. | 水 | B. | NaOH溶液 | C. | NaNO2溶液 | D. | HNO3 |
20.向盛有稀BaCl2(aq)的甲、乙两试管中分别通入SO2至饱和,若向甲试管中加入足量HNO3(aq),向乙试管中加入足量NaOH(aq).则下列叙述正确的是( )
| A. | 甲、乙两试管中都有白色沉淀生成 | |
| B. | 甲、乙两试管中都没有白色沉淀生成 | |
| C. | 甲试管中没有白色沉淀生成,而乙试管中有 | |
| D. | 乙试管中没有白色沉淀生成,而甲试管中有 |
17.三氯化磷分子的空间构型是三角锥形而不是平面正三角形.下列关于三氯化磷分子空间构型理由的叙述,正确的是( )
| A. | PCl3分子中三个共价键的键长相等 | |
| B. | PCl3分子中的P-Cl键属于极性共价键 | |
| C. | PCl3分子中三个共价键的键长、键角均相等 | |
| D. | PCl3分子中P-Cl键的三个键的键长相等,且属于极性分子 |
 大麻酚及它的衍生物都属麻醉药品,并且毒性较强.吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中.吸食大麻还可破坏男女的生育能力,而且由于大麻中焦油含量高,其致癌率也较高.大麻酚分子结构如图,回答下列问题:
大麻酚及它的衍生物都属麻醉药品,并且毒性较强.吸食大麻使人的脑功能失调、记忆力消退、健忘、注意力很难集中.吸食大麻还可破坏男女的生育能力,而且由于大麻中焦油含量高,其致癌率也较高.大麻酚分子结构如图,回答下列问题: .
.
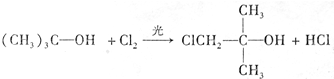 ;A转化为D的反应的类型消去反应.
;A转化为D的反应的类型消去反应.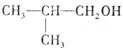 .
. .
. .
.