题目内容
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)合成氨反应N2(g)+3H2(g)?2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡 移动(填“向左”、“向右”或“不”);使用催化剂 反应的△H(填“增大”、“减小”或“不改变”).
(2)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式为 .
已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20.
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol?L-1、c(N2O4)=0.0120mol?L-1.则反应2NO2(g)?N2O4(g)的平衡常数K=
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00L已达到上述平衡的N2O4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu 克.
(1)合成氨反应N2(g)+3H2(g)?2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,平衡
(2)在25℃下,向浓度均为0.1mol?L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20.
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol?L-1、c(N2O4)=0.0120mol?L-1.则反应2NO2(g)?N2O4(g)的平衡常数K=
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00L已达到上述平衡的N2O4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu
考点:化学平衡的影响因素,反应热和焓变,难溶电解质的溶解平衡及沉淀转化的本质
专题:基本概念与基本理论
分析:(1)恒温恒压条件下向平衡体系中通入氩气,体积增大,等效为降低压强,平衡向体积增大的方向移动;
反应热只与始态与状态有关,催化剂改变平衡建立的途径,不影响始态与终态,反应热不变;
(2)Mg(OH)2、Cu(OH)2的结构类型相同,溶度积越小,溶解度越小,加入相同的浓度的氨水,最先析出;
(3)依据化学平衡三段式列式计算平衡浓度,结合平衡浓度是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
(4)计算N2O4和NO2的物质的量,根据电子转移计算Cu的物质的量,根据m=nM计算Cu的质量.
反应热只与始态与状态有关,催化剂改变平衡建立的途径,不影响始态与终态,反应热不变;
(2)Mg(OH)2、Cu(OH)2的结构类型相同,溶度积越小,溶解度越小,加入相同的浓度的氨水,最先析出;
(3)依据化学平衡三段式列式计算平衡浓度,结合平衡浓度是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积得到;
(4)计算N2O4和NO2的物质的量,根据电子转移计算Cu的物质的量,根据m=nM计算Cu的质量.
解答:
解:(1)恒温恒压条件下向平衡体系中通入氩气,体积增大,等效为降低压强,平衡向体积增大的方向移动,该反应正反应是体积减小的反应,故平衡向左移动.
反应热只与始态与状态有关,催化剂改变平衡建立的途径,不影响始态与终态,反应热不变,
故答案为:向左,不改变;
(2)Mg(OH)2、Cu(OH)2的结构类型相同,Cu(OH)2溶度积更小,溶解度越小,加入相同的浓度的氨水,Cu(OH)2最先析出,反应离子方程式为:Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+;
故答案为:Cu(OH)2,Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+;
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol?L-1、c(N2O4)=0.0120mol?L-1.则反应2NO2(g)?N2O4(g)的平衡常数K=
=13.3L/mol;
故答案为:13.3;
(4)N2O4的物质的量=1L×0.012 0mol?L-1=0.012mol,NO2的物质的量=1L×0.03 0mol?L-1=0.03mol,根据电子转移守恒可知,参加反应Cu的物质的量=
=0.027mol,故参加反应的Cu的质量为0.027mol×64g/mol=1.728g,
故答案为:1.728;
反应热只与始态与状态有关,催化剂改变平衡建立的途径,不影响始态与终态,反应热不变,
故答案为:向左,不改变;
(2)Mg(OH)2、Cu(OH)2的结构类型相同,Cu(OH)2溶度积更小,溶解度越小,加入相同的浓度的氨水,Cu(OH)2最先析出,反应离子方程式为:Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+;
故答案为:Cu(OH)2,Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+;
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol?L-1、c(N2O4)=0.0120mol?L-1.则反应2NO2(g)?N2O4(g)的平衡常数K=
| 0.0120 |
| 0.03002 |
故答案为:13.3;
(4)N2O4的物质的量=1L×0.012 0mol?L-1=0.012mol,NO2的物质的量=1L×0.03 0mol?L-1=0.03mol,根据电子转移守恒可知,参加反应Cu的物质的量=
| 0.0300mol×1+0.012mol×2 |
| 2 |
故答案为:1.728;
点评:本题考查化学平衡影响因素和计算、平衡常数计算、氧化还原反应计算,难度中等,(4)中注意利用电子转移守恒计算.

练习册系列答案
相关题目
下列装置或操作不能达到实验目的是( )
A、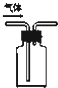 利用排空气法收集CO2 利用排空气法收集CO2 |
B、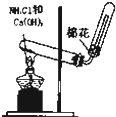 实验室制取NH3 实验室制取NH3 |
C、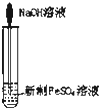 实验室制取Fe(OH)2 实验室制取Fe(OH)2 |
D、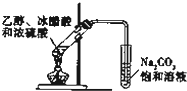 实验室制乙酸乙酯 实验室制乙酸乙酯 |
欲从苯酚的乙醇溶液中分离苯酚和乙醇,有下列操作:
①过滤 ②蒸馏 ③静置分液 ④加入足量的金属钠 ⑤加入足量的NaOH溶液 ⑥通入过量的二氧化碳 ⑦加入足量的FeCl3溶液 ⑧加入乙酸与浓硫酸混合液加热.
合理的实验操作步骤及顺序是( )
①过滤 ②蒸馏 ③静置分液 ④加入足量的金属钠 ⑤加入足量的NaOH溶液 ⑥通入过量的二氧化碳 ⑦加入足量的FeCl3溶液 ⑧加入乙酸与浓硫酸混合液加热.
合理的实验操作步骤及顺序是( )
| A、④⑤③ | B、⑥①⑤③ |
| C、⑧①⑦③ | D、⑤②⑥③ |
对于主族元素R形成化合物的分子式为HROm,其水溶液呈酸性,下列说法中正确的是( )
| A、m越大,其HROm的氧化性越强 |
| B、m越大,其HROm的酸性越强 |
| C、与Zn反应时,只能产生一种气体 |
| D、当m=3时,R一定为ⅤA族 |
某无色溶液中能大量共存的一组离子是( )
| A、OH-、Ba2+、NH4+、Cl- |
| B、K+、Fe2+、H+、NO3- |
| C、NH4+、Al3+、Cl-、NO3- |
| D、Mg2+、SO42-、SiO32-、H+ |
化学物质双酚A(结构如图).关于双酚A的下列说法正确的是( )


| A、该化合物属于芳香烃 |
| B、该化合物可以跟溴水发生取代反应和加成反应 |
| C、双酚A不能使FeCl3溶液显紫色 |
| D、该化合物可以跟Na2CO3溶液反应放出CO2 |
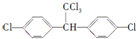 的有机物中,分子中最多有
的有机物中,分子中最多有 2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备.请回答下列问题:
2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备.请回答下列问题: