题目内容
根据下列五种元素的第一至第四电离能数据(单位:kJ?mol-1),回答下列各题:
(1)在周期表中,最可能处于同一族的是 .
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是 .
A.S2+ B.R2+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是 .
A.硼 B.铍 C.氦 D.氢
(4)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明: ,如果U元素是短周期元素,你估计它的第2次电离能飞跃数据将发生在失去第 个电子时.
(5)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是 ,其中元素 的第一电离能异常高的原因是 .
| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2 080 | 4 000 | 6 100 | 9 400 |
| R | 496 | 4 562 | 6 912 | 9 543 |
| S | 738 | 1 451 | 7 733 | 10 540 |
| T | 578 | 1 817 | 2 745 | 11 575 |
| U | 420 | 3 100 | 4 400 | 5 900 |
A.Q和R B.S和T C.T和U D.R和T E.R和U
(2)下列离子的氧化性最弱的是
A.S2+ B.R2+ C.T3+ D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是
A.硼 B.铍 C.氦 D.氢
(4)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明:
(5)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是
考点:元素周期表的结构及其应用,元素周期律的作用,元素电离能、电负性的含义及应用
专题:元素周期律与元素周期表专题
分析:由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现+2价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现+3价,最外层电子数为3,
(1)R和U的第一至第四电离能变化规律相似,即R和U最可能在同一主族;
(2)离子的氧化性最弱,即其对应的电离能最小;
(3)Q元素各电离能都较大,而且各电离能之间无太大差距,故Q最可能为稀有气体元素;
(4)相邻两个电离能数据相差较大,从一个侧面说明电子是分层排布的,且各能层能量不同;
若U为短周期元素,据表中数据第一次电离能飞跃是失去第2个电子时,可推知U在ⅠA族,则第二次电离能飞跃是在失去第一能层电子时发生;
(5)根据最外层电子数确定原子序数,S元素的第一电离能失去的是s能级的电子,s能级为全满稳定结构、能量降低,故第一电离能反常.
(1)R和U的第一至第四电离能变化规律相似,即R和U最可能在同一主族;
(2)离子的氧化性最弱,即其对应的电离能最小;
(3)Q元素各电离能都较大,而且各电离能之间无太大差距,故Q最可能为稀有气体元素;
(4)相邻两个电离能数据相差较大,从一个侧面说明电子是分层排布的,且各能层能量不同;
若U为短周期元素,据表中数据第一次电离能飞跃是失去第2个电子时,可推知U在ⅠA族,则第二次电离能飞跃是在失去第一能层电子时发生;
(5)根据最外层电子数确定原子序数,S元素的第一电离能失去的是s能级的电子,s能级为全满稳定结构、能量降低,故第一电离能反常.
解答:
解:由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现+2价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现+3价,最外层电子数为3,则
(1)由上述分析可知,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,故答案为:E;
(2)离子的氧化性最弱,即其对应的电离能最小,由表中数据看出U的第一电离能为420 kJ?mol-1,数值最小,故U+氧化性最弱,故答案为:D;
(3)由表中数据可知,Q元素各电离能都较大,而且各电离能之间无太大差距,故Q最可能为稀有气体元素,化学性质和物理性质最像氦,故答案为:C;
(4)相邻两个电离能数据相差较大,从一个侧面说明核外电子分层排布的,且各能层能量不同.若U为短周期元素,据表中数据第一次电离能飞跃是失去第2个电子时,可推知U在ⅠA族,则第二次电离能飞跃是在失去第10个电子时发生的,
故答案为:电子分层排布,且各能层能量不同;10;
(5)由上述分析可知,R最外层电子数为1,S的最外层电子数为2,T的最外层电子数为3,R、S、T若是同周期的三种主族元素,则它们的原子序数由小到大的顺序是R<S<T,其中由于S的第一电离能失去的是s能级的电子,s能级为全满稳定结构、能量降低,第一电离能反常高.
故答案为:R<S<T;S;S元素的第一电离能失去的是s能级的电子,s能级为全满稳定结构、能量降低.
(1)由上述分析可知,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,故答案为:E;
(2)离子的氧化性最弱,即其对应的电离能最小,由表中数据看出U的第一电离能为420 kJ?mol-1,数值最小,故U+氧化性最弱,故答案为:D;
(3)由表中数据可知,Q元素各电离能都较大,而且各电离能之间无太大差距,故Q最可能为稀有气体元素,化学性质和物理性质最像氦,故答案为:C;
(4)相邻两个电离能数据相差较大,从一个侧面说明核外电子分层排布的,且各能层能量不同.若U为短周期元素,据表中数据第一次电离能飞跃是失去第2个电子时,可推知U在ⅠA族,则第二次电离能飞跃是在失去第10个电子时发生的,
故答案为:电子分层排布,且各能层能量不同;10;
(5)由上述分析可知,R最外层电子数为1,S的最外层电子数为2,T的最外层电子数为3,R、S、T若是同周期的三种主族元素,则它们的原子序数由小到大的顺序是R<S<T,其中由于S的第一电离能失去的是s能级的电子,s能级为全满稳定结构、能量降低,第一电离能反常高.
故答案为:R<S<T;S;S元素的第一电离能失去的是s能级的电子,s能级为全满稳定结构、能量降低.
点评:本题考查电离能知识,题目难度中等,注意原子的最外层电子与电离能以及化合价的关系.

练习册系列答案
相关题目
下列反应中亚硫酸溶液表现的性质与另外三种不同的是( )
| A、能使酸性高锰酸钾溶液褪色 |
| B、在空气中久置,溶液pH变小 |
| C、能使溴水褪色 |
| D、加入氢氧化钡溶液产生白色沉淀 |
向含有NaBr和KI的混合溶液中通入氯气充分反应后将溶液蒸干,并灼烧所得物质,最后剩余的固体可能是( )
| A、NaCl和KI |
| B、NaCl和I2 |
| C、KCl和NaBr |
| D、KCl和I2 |
下列有关物质应用的说法错误的是( )
| A、CCl4曾用作灭火剂,但因与水在高温下反应会产生有毒物质,现已被禁用 |
| B、工厂中常用的静电除尘装置是根据胶体带电这个性质而设计的 |
| C、Li是最轻的金属,也是活动性较强的金属,是制造电池的理想物质 |
| D、为了延长果实或花朵的成熟期,可用浸泡过高锰酸钾溶液的硅土吸收水果或花朵产生的乙烯 |
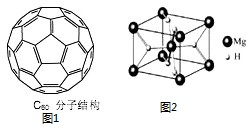 氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.
氢的存储是氢能应用的主要瓶颈,目前所采用或正在研究的主要储氢材料有:配位氢化物、富氢载体化合物、碳质材料、金属氢化物等.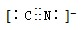
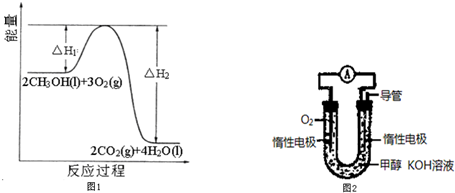
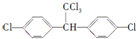 的有机物中,分子中最多有
的有机物中,分子中最多有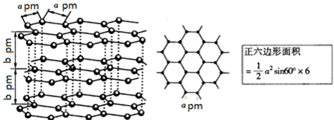 2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备.请回答下列问题:
2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备.请回答下列问题: