题目内容
【题目】中国的铀工业自20世纪50年代兴起,现已形成完整的和具有相当规模的科研和工业生产体系。铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4〔UO2(CO3)3〕等。回答下列问题:
(1)UF4用Mg或Ca还原可得金属铀。
①基态氟原子的价电子排布图为_____________;
②金属铀的一种堆积方式为体心立方堆积,该堆积方式的空间利用率为_______;
③UF4用Mg或Ca还原时,其氧化产物是MgF2或CaF2,已知MgF2的熔点高于CaF2,其原因是_________________。
(2)已知:(NH4)4〔UO2(CO3)3〕![]() 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
①(NH4)4〔UO2(CO3)3〕存在的微粒间作用力是_________;
a. 离子键 b. 共价键 c. 配位键 d. 金属键
②NH4+的空间构型为______,与NH4+等电子体的分子或离子有_____(写一种);
③CO32-中碳原子杂化轨道类型为_________;
(3)UO2的晶胞结构如图所示:

①晶胞中U原子位于面心和顶点,氧原子填充在U原子堆积形成的空隙中,在该空隙中氧原子堆积形成的立体的空间构型为___________(填“立方体”、“四面体”、“八面体”);
②若两个氧原子间的最短距离为a nm,则UO2晶体的密度为__________g·cm-3。(列出含a算式即可。用NA表示阿伏加德罗常数的值。)
【答案】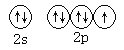 68% MgF2或CaF2均为离子晶体,MgF2的晶格能大于CaF2 abc 正四面体 CH4 sp2 立方体
68% MgF2或CaF2均为离子晶体,MgF2的晶格能大于CaF2 abc 正四面体 CH4 sp2 立方体 ![]()
【解析】
(1)①F元素常用第二周期VIIA族,价电子排布式为2s22p5,结合泡利原理、洪特规则画出价电子排布图; ②根据体心立方堆积晶胞的内部结构计算空间利用率,空间利用率=![]() ;
;
③CaF2和MgF2都是离子晶体,离子电荷相同,离子半径越小,晶格能越大,晶体的熔点越高;
(2)①(NH4)4〔UO2(CO3)3〕为离子晶体,含有离子键,铵根离子中有共价键和配位键;
②根据VSEPR理论判断NH4+的空间构型,等电子体是指原子总数相同,价电子总数也相同的微粒;
③根据VSEPR理论和杂化轨道理论判断;
(3)①由UO2的晶胞结构,氧原子与周围的4个U原子形成正四面体结构,氧原子位于正四面体的中心;
②如图晶胞内部上半部4个O原子形成正方形,正方形边长为晶胞棱长的![]() ,均摊法计算晶胞中U、O原子数目,用阿伏伽德罗常数表示出晶胞质量,晶体密度=晶胞质量÷晶胞体积。
,均摊法计算晶胞中U、O原子数目,用阿伏伽德罗常数表示出晶胞质量,晶体密度=晶胞质量÷晶胞体积。
(1)①F原子价电子排布式为2s22p5,由泡利原理、洪特规则,价层电子排布图为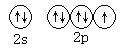 ;
;
②根据体心立方堆积晶胞的内部结构,1个体心立方晶胞含有硬球数目为8×![]() +1=2个,设硬球边长为a,根据硬球接触模型,则硬球半径与晶胞边长的关系为4r=
+1=2个,设硬球边长为a,根据硬球接触模型,则硬球半径与晶胞边长的关系为4r=![]() a,所以r=
a,所以r=![]() a,所以空间利用率=
a,所以空间利用率=![]() =
=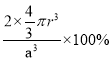 =
=![]() ×100%=68%;
×100%=68%;
③MgF2和CaF2均为离子晶体,Mg2+半径小于Ca2+半径,MgF2的晶格能大于CaF2,故MgF2的熔点较高;
(2)①(NH4)4〔UO2(CO3)3〕为离子晶体,含有离子键,铵根离子中有共价键和配位键;
②对于NH4+,根据VSEPR理论,价电子对数为VP=BP+LP=4+![]() =4,VSEPR模型为四面体形,形成4根NH键,则其空间构型为正四面体;
=4,VSEPR模型为四面体形,形成4根NH键,则其空间构型为正四面体;
等电子体是指原子总数相同,价电子总数也相同的微粒,所以与NH4+互为等电子体的分子或离子有:CH4、BH4(或BeH42、AlH4、SiH4及GeH4);
③对于CO32,根据VSEPR理论,价电子对数为VP=BP+LP=3+![]() =3,根据杂化轨道理论,中心C为sp2杂化;
=3,根据杂化轨道理论,中心C为sp2杂化;
(3)①氧原子与周围的4个U原子形成正四面体结构,氧原子位于正四面体的中心,则氧原子填充在铀原子形成的正四面体空隙中;
②如图晶胞内部上半部4个O原子形成正方形,正方形边长为晶胞棱长的![]() ,若两个氧原子的最近距离为a nm,则晶胞棱长为2a nm,晶胞体积=(2a×107cm)3,U原子数目=8×
,若两个氧原子的最近距离为a nm,则晶胞棱长为2a nm,晶胞体积=(2a×107cm)3,U原子数目=8×![]() +6×
+6×![]() =4,O原子数目=8,晶胞质量=
=4,O原子数目=8,晶胞质量=![]() g,故晶体密度=
g,故晶体密度=![]() g÷(2a×107cm)3=
g÷(2a×107cm)3=![]() gcm3。
gcm3。

【题目】有机物A可由葡萄糖发酵得到,也可以从牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍 | 试通过计算填空: (1)A的相对分子质量为__。 |
将9.0gA在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为__。 |
另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 | (3)用结构简式表示A中含有的官能团__、__。 |
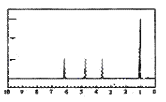
A的核磁共振氢谱如图:
| (4)A中含有__种氢原子。 综上所述,A的结构简式为__。 |
【题目】几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。(请用化学用语答题)
元素代号 | X | Y | Z | M | R |
原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
主要化合价 | +1 | +6 -2 | +5 -3 | -2 | +3 |
(1)R的元素符号为___,M在元素周期表中的位置为___。
(2)X与Y按原子个数比1∶1构成的物质的电子式为___,所含化学键类型___。
(3)X+、Y2-、M2-离子半径大小顺序为___。
(4)将YM2通入FeCl3溶液中的离子方程式:___。
【题目】下列有机化学反应方程式及反应类型均正确的是
选项 | 化学反应方程式 | 反应类型 |
A | CH3COOH+CH3CH2OH | 酯化反应 |
B | CH4+Cl2 | 置换反应 |
C | CH2=CH2+Br2 CH3CHBr2 | 加成反应 |
D |
| 取代反应 |
A. A B. B C. C D. D