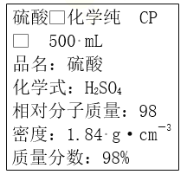
��Ŀ����
����Ŀ������������Ӧ�ù㷺������ɫ���������������������ȶ������Ի��������������ֽ⣮��գ�
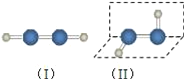
��1����������ķ��ӽṹ��ͼ�����������������__������/�Ǽ��ԣ����ӣ���ȥ����������Ϊ��������ķ��ӽṹҲ�����ǣ���ѡ�����ʵ�鷽��֤����������ķ��ӽṹΪ����__��ѡ���ţ���
a���ⶨ��������ķе�
b���ⶨ��������ֽ�ʱ�����յ�����
c���ⶨ����������H��O��O��O�ļ���
d���۲��������ϸ���Ƿ��ڵ糡��ƫת
Na2O2��K2O2�Լ�BaO2���������������ɹ������⣮ʵ���ҿ���ϡ��������������ñ���ȴ�������·�Ӧ��ȡ�������⣮
��2�������������������ʺϵ���__����Ӧ��Ϻ�__����������ƣ����ɵõ�˫��ˮ��
��3������Ӧʱû���ñ���ȴ���������������д����Ӧ�Ļ�ѧ����ʽ__�������Ը��������Һ�ζ�˫��ˮ�ķ������Բⶨ˫��ˮ��Ũ�ȣ�
��4��ȡ5.00mL ˫��ˮ��Ʒ�����Ƴ�250mL��Һ����ʵ����̱����õ���������Ҫ����Ϊ__�����������ƣ���
��5��ȡ25.00mL������Һ����0.020mol/L�����Ը��������Һ�ζ�������__������ζ��յ㣬���ĸ��������Һ15.50mL����ԭ˫��ˮ��Ʒ�к���������__ g/L��
���𰸡����� d BaO2 ���� 2BaO2+2H2SO4=2BaSO4+O2��+2H2O ��ʽ�ζ��ܡ�250mL����ƿ ��Һ��dz�Ϻ�ɫ�Ұ�����ڲ���ɫ 52.7g/L
��������
��1���ɼ��Լ����ɵķ��ӣ����ṹ���Գƣ�����������IJ��ص���Ϊ���Է��ӣ����Է���ϸҺ���ڵ糡�лᷢ��ƫת��
��2��������Ŀ��Ϣ��ʵ����ͨ������ij�ֹ�������������ϡ�������ã����˺��Ƶýϴ�����H2O2��Һ��˵����һ�ֲ���Ϊ������
��3��BaO2�����ᷴӦ�������ᱵ��������ˮ��
��4��˫��ˮ����ǿ����������ʽ�ζ�����ȡ������250mL��Һ��Ҫ250mL����ƿ��
��5�����Ը��������ҺΪ��ɫ���ﵽ�ζ��յ�ʱ��Һ��dz�Ϻ�ɫ�Ұ�����ڲ���ɫ�����ݷ�Ӧ����ʽ����25mL��Һ��˫��ˮ�����ʵ�����Ȼ������������������1L��Һ�е�˫��ˮ��������
��1��H2O2�����к������⼫�Թ��ۼ��������Ǽ��Թ��ۼ����ɼ��Լ����ɵķ��ӣ����ṹ���Գƣ�����������IJ��ص���Ϊ���Է��ӣ����Է���ϸҺ���ڵ糡�лᷢ��ƫת��
a.���ӵ��۷е�����Ӽ��������йأ�������Ƿ�Գ��أ���a����
b.��������ֽ�ʱ���յ��������������ļ����йأ�������Ƿ�Գ��أ���b����
c.ͼʾ���ֽṹ��������������е�����������������������ͬ�������𣬹�c����
d.ͼʾ���ֽṹ������1Ϊ�Գƽṹ�ķǼ��Է��ӣ�����2Ϊ�ǶԳƽṹ�ļ��Է��ӣ����Է���ϸҺ���ڵ糡�з���ƫת���Ǽ��Է���ϸҺ���ڵ糡�в�����ƫת���۲��������ϸҺ���ڵ糡���Ƿ���ƫת����ȷ���²�����һ����ȷ����d��ȷ��
�ʴ�Ϊ�����ԣ�d��
��2��ʵ����ͨ������ij�ֹ�������������ϡ�������ã����˺��Ƶýϴ�����H2O2��Һ��˵����һ�ֲ���Ϊ�����������������ᱵ����������ѡ��BaO2����Ӧ���ɹ�����������ᱵ���������˼��ɵõ������Ĺ������⣻
�ʴ�Ϊ��BaO2�����ˣ�
��3��������Ӧʱû���ñ���ȴ��������������������ɵ���������BaO2�����ᷴӦ�������ᱵ��������ˮ���䷴Ӧ�Ļ�ѧ����ʽΪ��2BaO2+2H2SO4��2BaSO4+O2��+2H2O��
�ʴ�Ϊ��2BaO2+2H2SO4��2BaSO4+O2��+2H2O��
��4��˫��ˮ����ǿ����������ʽ�ζ�����ȡ������250mL��Һ��Ҫ250mL����ƿ������ȡ5.00mL ˫��ˮ��Ʒ�����Ƴ�250mL��Һ��ʵ����̱����õ���������Ҫ����Ϊ��ʽ�ζ��ܡ�250 mL����ƿ��
�ʴ�Ϊ����ʽ�ζ��ܡ�250 mL����ƿ��
��5�����Ը��������ҺΪ��ɫ���ﵽ�ζ��յ�ʱ˫��ˮ��ȫ��Ӧ����Һ��Ϊdz�Ϻ�ɫ�Ұ�����ڲ���ɫ����Ӧ���ӷ���ʽ�ǣ�2MnO4��+5H2O2+6H+��2Mn2++5O2��+8H2O��n(MnO4��)��cV��0.020mol/L��0.0155L��3.10��10��4mol��n(H2O2)��![]() n(MnO4��)��
n(MnO4��)��![]() ��3.10��10��4mol����25.00mL������Һ��˫��ˮ��������m(H2O2)��nM��
��3.10��10��4mol����25.00mL������Һ��˫��ˮ��������m(H2O2)��nM��![]() ��3.10��10��4mol��34g/mol��2.635��10��2g����250mL��Һ�к���m(H2O2)= 2.635��10��1g������1000mL��1L˫��ˮ��Ʒ��Һ��˫��ˮ��������m(H2O2)��2.635��10��1g��
��3.10��10��4mol��34g/mol��2.635��10��2g����250mL��Һ�к���m(H2O2)= 2.635��10��1g������1000mL��1L˫��ˮ��Ʒ��Һ��˫��ˮ��������m(H2O2)��2.635��10��1g��![]() ��52.7g������ԭ˫��ˮ��Ʒ�к���������52.7g/L��
��52.7g������ԭ˫��ˮ��Ʒ�к���������52.7g/L��
�ʴ�Ϊ����Һ��dz�Ϻ�ɫ�Ұ�����ڲ���ɫ��52.7��