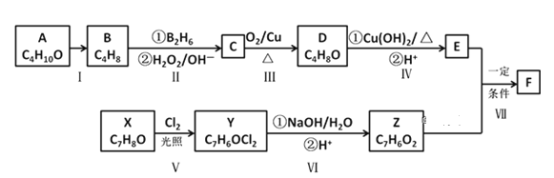
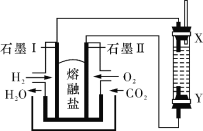
��Ŀ����
����Ŀ�������������������ڴ��������еĵ�����������Ļ�ѧ��ӦΪ��2NH3(g)��NO(g)��NO2(g)![]() 2N2(g)��3H2O(g)����H<0���ں��ݵ��ܱ������У������й�˵����ȷ����(����)
2N2(g)��3H2O(g)����H<0���ں��ݵ��ܱ������У������й�˵����ȷ����(����)
A.��λʱ��������NO��N2�����ʵ�����Ϊ1��2ʱ����Ӧ�ﵽƽ��
B.ƽ��ʱ�������������䣬�����¶ȿ�ʹ�÷�Ӧ��ƽ�ⳣ������
C.ƽ��ʱ�������������䣬����NH3��Ũ�ȣ������е��������ת���ʼ�С
D.�����������䣬ʹ�ø�Ч�����������е��������ת��������
���𰸡�A
��������
A����Ӧ���ʵķ����෴�����������ʵ����仯֮������Ӧ�Ļ�ѧ������֮�ȣ���˵����Ӧ�ﵽƽ��״̬����A��ȷ��
B������Ӧ�Ƿ��ȷ�Ӧ�����������¶�ƽ�����淴Ӧ�����ƶ�����ƽ�ⳣ����С����B����
C������NH3��Ũ�ȣ�ƽ��������Ӧ�����ƶ��������е��������ת��������C����
D���������ܸı�ƽ��״̬�����Է����е��������ת���ʲ��䣬��D����
�ʴ�Ϊ��A��

��ϰ��ϵ�д�
 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
�����Ŀ