题目内容
【题目】按要求填空:
(1)将过量的氨水加入氯化铝溶液的离子方程式_____;
(2)浓硝酸久置后会略显黄色,可用方程式表示为_____;
(3)用KOH作电解质溶液,氢氧燃料电池负极反应式为_____;
(4)用方程式表示氯化铵溶液呈酸性原因_____。
【答案】Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 4HNO3![]() 4NO2↑+O2↑+2H2O H2-2e-+2OH-=2H2O NH4++H2O
4NO2↑+O2↑+2H2O H2-2e-+2OH-=2H2O NH4++H2O![]() NH4++H+
NH4++H+
【解析】
根据物质的性质及水解反应原理分析书写反应方程式及离子方程式。
(1)氨水与氯化铝溶液反应生成氢氧化铝沉淀,氢氧化铝与弱碱氨水不反应,离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
(2)浓硝酸久置后会分解放出二氧化氮气体,溶解于硝酸显黄色,反应方程式为4HNO3![]() 4NO2↑+O2↑+2H2O,故答案为:4HNO3
4NO2↑+O2↑+2H2O,故答案为:4HNO3![]() 4NO2↑+O2↑+2H2O;
4NO2↑+O2↑+2H2O;
(3)氢氧燃料电池中,氢气作负极,负极失去电子,发生氧化反应,反应式为H2-2e-+2OH-=2H2O,故答案为:H2-2e-+2OH-=2H2O;
(4)氯化铵溶液呈酸性是因为铵根离子水解,反应方程式为:NH4++H2O![]() NH4++H+,故答案为:NH4++H2O
NH4++H+,故答案为:NH4++H2O![]() NH4++H+。
NH4++H+。

【题目】填空:
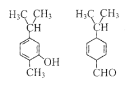
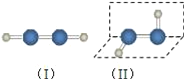
I. 某有机物由C、H、O三种元素组成,球棍模型如图所示:

(1)该有机物的分子式是_____________;
(2)该有机物所含官能团的名称是_____________;
(3)该有机物可以发生加聚反应,其产物的结构简式是_____________;
(4)下列有关该有机物的描述中,正确的是_____________(填序号)。
a. 能与NaHCO3溶液反应 b. 能发生水解反应
c. 不能与溴的CCl4溶液反应 d. 能与酸性高锰酸钾溶液反应
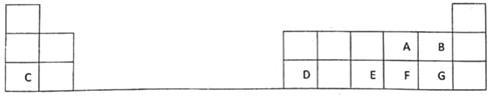
II. 实验室制得气体中常含有杂质,影响其性质检验。下图A为除杂装置,B为性质检验装置,完成下列表格:

序号 | 气体 | 反应原理 | A中试剂 |
① | 乙烯 | 溴乙烷和NaOH的醇溶液加热 | ______________ |
② | 乙烯 | 无水乙醇在浓硫酸的作用下加热至170℃反应的化学方程式是__________ | ______________ |
③ | 乙炔 | 电石与饱和食盐水反应 | ______________ |