题目内容
【题目】下列有关化学反应的表述正确的是
A.电解熔融NaCl:2Cl-+2H2O![]() 2OH-+Cl2↑+H2↑
2OH-+Cl2↑+H2↑
B.NaHS溶液显碱性:HS-+H2O![]() H3O++S2-
H3O++S2-
C.明矾净水:Al3++3H2O=Al(OH)3(胶体)+3H+
D.制备TiO2纳米粉:TiCl4+(x+2)H2O(过量) = TiO2·xH2O↓+4HCl
【答案】D
【解析】
盐溶液显性原理,物质净水原理为可逆反应,电解熔融的NaCl没有水的参与,据此回答。
A.题目离子方程式为电解NaCl溶液,电解熔融NaCl:2Cl-+2Na+![]() 2Na+Cl2↑,A错误;
2Na+Cl2↑,A错误;
B.NaHS溶液显碱性原因为HS-水解:HS-+H2O![]() H2S+OH-,B错误;
H2S+OH-,B错误;
C.明矾净水原理为Al3+水解产生絮状胶体,胶体具有吸附性:Al3++3H2O![]() Al(OH)3(胶体)+3H+,C错误;
Al(OH)3(胶体)+3H+,C错误;
D.制备TiO2纳米粉:TiCl4+(x+2)H2O(过量) = TiO2·xH2O↓+4HCl,D正确。
答案为D。

【题目】如图是某同学研究铜与浓硫酸的反应装置:
完成下列填空:
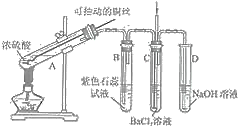
(1)写出A中发生反应的化学方程式______,采用可抽动铜丝进行实验的优点是______。
(2)反应一段时间后,可观察到B试管中的现象为______。
(3)从C试管的直立导管中向BaCl2溶液中通入另一种气体,产生白色沉淀,则气体可以是______、______.(要求填一种化合物和一种单质的化学式)。
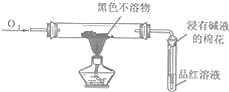
(4)反应完毕,将A中的混合物倒入水中,得到呈酸性的蓝色溶液与少量黑色不溶物,分离出该不溶物的操作是______,该黑色不溶物不可能是CuO,理由是______。
(5)对铜与浓硫酸反应产生的黑色不溶物进行探究,实验装置及现象如下:
实验装置 | 实验现象 |
| 品红褪色 |
①根据实验现象可判断黑色不溶物中一定含有______元素。
②若该黑色不溶物由两种元素组成且在反应前后质量保持不变,推测其化学式为______。