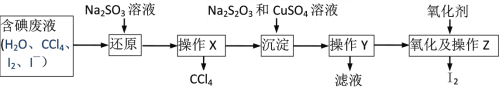
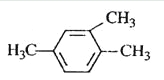
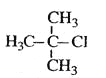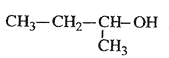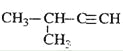��Ŀ����
����Ŀ����������Ϊ�����л��
�ټױ� ��1��3������ϩ ��ֱ������ ��ֲ����
��գ�
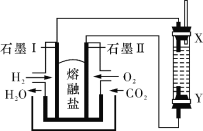
��1������ʹ��ˮ������ѧ�仯��ɫ��Ҳ��ʹ���Ը��������ɫ������____�����ţ���
��2���ܺ�����������Һ��Ӧ����______�����ţ���д���÷�Ӧ����֮һ�����������Ļ�ѧ����ʽ______��
��3����֪������ϩ����ͨ��1��3������ϩ����ϩ���������ӳɷ�Ӧ�õ���
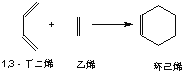
ʵ��֤�������з�Ӧ�У���Ӧ����ӵĻ���˫���Ȼ���˫�������ױ�������
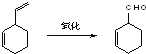
�ֽ���1��3������ϩΪ�л�ԭ�ϣ����Լ���ѡ��������;���ϳɼ������飺
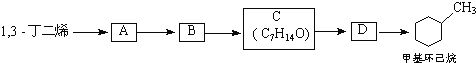
��a��д���ṹ��ʽ��A______��B_____
��b������������������黥Ϊͬϵ�����_______
��c��1mol A��1mol HBr�ӳɿ��Եõ�_____�ֲ��
���𰸡��� �� 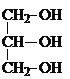 +3HNO3��
+3HNO3��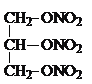 +3H2O
+3H2O 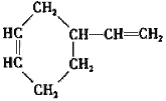
 A 4
A 4
��������
(1)ֲ���������������ʣ�����ʹ��ˮ������ѧ�仯��ɫ��Ҳ��ʹ���Ը��������ɫ��������̼̼�����ͼ����ݴ˷����жϣ�
(2)��������NaOH��Ӧ�����ܹ���NaOH��Һ��ˮ�⣬�ݴ˷������
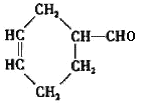
(3)����̼ԭ����Ŀ��֪����Ӧ��Ϊ1��3-����ϩ��CH2=CH-CH3������Ϣ��Ӧ����A����AΪ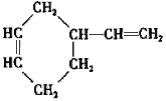 ��A������Ϣ��ķ�Ӧ����B����BΪ
��A������Ϣ��ķ�Ӧ����B����BΪ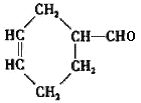 �����C�ķ���ʽ��֪��B����������ȫ�ӳɷ�Ӧ����C��CΪ
�����C�ķ���ʽ��֪��B����������ȫ�ӳɷ�Ӧ����C��CΪ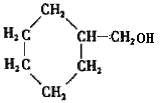 ��C������ȥ��Ӧ����D��DΪ
��C������ȥ��Ӧ����D��DΪ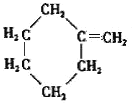 ��D�����ӳɷ�Ӧ���ɼ������飬�ݴ˷������
��D�����ӳɷ�Ӧ���ɼ������飬�ݴ˷������
(1)ֲ���������������ʣ����������ױ���ֱ�������в�����̼̼˫��������ʹ��ˮ������ѧ��Ӧ��ɫ��1��3-����ϩ�к���̼̼˫�����ܹ�����ˮ�����ӳɷ�Ӧ���ܹ������Ը������������ʹ���������Һ��ɫ���ʴ�Ϊ���ڣ�
(2)��������NaOH��Ӧ�����ܹ���NaOH��Һ�з���ˮ�ⷴӦ��ֲ�����Ǹ�֬�����������ˮ�����ɸ��ͣ������ܹ������ᷢ��������Ӧ����Ӧ����ʽΪ��
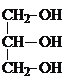 +3HNO3��
+3HNO3��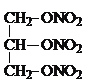 +3H2O���ʴ�Ϊ���ܣ�
+3H2O���ʴ�Ϊ���ܣ�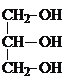 +3HNO3��
+3HNO3��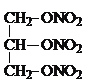 +3H2O��
+3H2O��
(3)(a)ͨ�����Ϸ���֪��A�Ľṹ��ʽ�� ��B�Ľṹ��ʽ��
��B�Ľṹ��ʽ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
�� ��
��
(b)����������������������������黥Ϊͬϵ�����A���ʴ�Ϊ��A��
(c)A�Ľṹ��ʽ�� ��������2��̼̼˫���ϵ�4��Cԭ�Ӷ�����Ч������Brԭ�Ӽӳɵ�4��Cԭ���ϵIJ��ﶼ����ͬ�����A��HBr�ӳ�ʱ�IJ�����4�֣��ʴ�Ϊ��4��
��������2��̼̼˫���ϵ�4��Cԭ�Ӷ�����Ч������Brԭ�Ӽӳɵ�4��Cԭ���ϵIJ��ﶼ����ͬ�����A��HBr�ӳ�ʱ�IJ�����4�֣��ʴ�Ϊ��4��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�