题目内容
14.下列对于反应3NO2+H2O=2HNO3+NO的说法中正确的是( )| A. | 氧化剂与还原剂的质量比为1:2 | |
| B. | NO2是氧化剂水是还原剂 | |
| C. | 生成1molNO则有6mol电子发生转移 | |
| D. | 氧化剂与还原剂的物质的量比为2:1 |
分析 该反应中N元素的化合价由+4价变为+5价和+2价,所以二氧化氮既是氧化剂又是还原剂,硝酸是氧化产物,NO是还原产物,根据二氧化氮和转移电子之间的关系式计算转移电子的物质的量.
解答 解:A.该反应中N元素的化合价由+4价变为+5价和+2价,所以生成硝酸的二氧化氮是还原剂,其计量数是2,生成NO的二氧化氮是氧化剂,其计量数是1,所以氧化剂和还原剂的物质的量、质量之比都是1:2,故A正确;
B.该反应中N元素的化合价由+4价变为+5价和+2价,所以二氧化氮既是氧化剂又是还原剂,水中各元素都不变,所以既不是氧化剂又不是还原剂,故B错误;
C.在反应中若生成1molNO时,则有2molNO2被还原,所以有2mol电子发生转移,故C错误;
D.由A分析可知,氧化剂与还原剂的物质的量比为2:1,故D错误;
故选A.
点评 本题考查氧化还原反应,明确元素化合价是解本题关键,注意该反应中化合价变化的元素只有N元素,为易错点.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
4.已知12g石墨在一定条件下转化成金刚石要吸收QkJ的热量,由此可能得出的正确结论是( )
| A. | 石墨比金刚石稳定 | |
| B. | 等质量的石墨和金刚石比较,石墨具有的能量较高 | |
| C. | 等质量的石墨和金刚石完全燃烧,金刚石放出的能量较多 | |
| D. | 石墨转化为金刚石是物理变化 |
5.人造地球卫星用到的一种高能电池--银锌蓄电池,其电极分别是Ag2O和Zn,电解液是KOH溶液.放电时,该电池的电极反应式为Zn+2OH--2e-=Zn(OH)2,Ag2O+H2O+2e-=2Ag+2OH-.下列说法中正确的是( )
①锌为负极,Ag2O为正极;
②放电时,正极附近溶液OH-浓度增大;
③工作时电流由Ag2O极经外电路流向Zn极;
④溶液中阴离子向正极方向移动,阳离子向负极方向移动.
①锌为负极,Ag2O为正极;
②放电时,正极附近溶液OH-浓度增大;
③工作时电流由Ag2O极经外电路流向Zn极;
④溶液中阴离子向正极方向移动,阳离子向负极方向移动.
| A. | 只有① | B. | 只有②③ | C. | 只有①③④ | D. | 只有①②③ |
2.下列各组微粒中,核外电子总数相等的是( )
| A. | Na+和Li+ | B. | CO和CO2 | C. | H2O 和Al3+ | D. | NO和CO |
19.下列说法不正确的是( )
| A. | 某元素的一种核素X失去两个电子后,电子数为a,中子数为b,则该核素质量数为a+2+b | |
| B. | 某元素的一种核素X的质量数为A,含有N个中子,则ag 1HmX分子中所含质子数是$\frac{a}{A+m}(A-N)×{N_A}$ | |
| C. | 我国最近合成的一种新核素${\;}_{15}^{25}$P,该核素形成的最高价氧化物化学式为P2O5 | |
| D. | 活泼金属元素R有某种核素的氯化物RClx,该氯化物中R微粒核内中子数为y,核外电子数为z,该核素可以表示为x+zx+y+zR |
6.下列各组有机物只用一种试剂无法鉴别的是( )
| A. | 乙醇、苯酚、硝基苯 | B. | 苯、乙醛、己烯 | ||
| C. | 甲酸、甲苯、乙酸 | D. | 苯乙烯、甲苯、环己烷 |
3.下列用系统命名法命名的有机物名称正确的是( )
| A. | 2-甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 2,3-二甲基-1-戊烯 | D. | 1,2,4-三甲基-1-丁醇 |
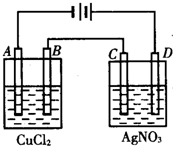 如图为以惰性电极进行电解:
如图为以惰性电极进行电解: 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )