题目内容
【题目】用中和滴定法测定某烧碱样品的纯度.有以下步骤:
(1)配制待测液:用5.00g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液,除烧杯、胶头滴管、玻璃棒外,还需要的玻璃仪器有 ______ 。
(2)滴定:
①盛装0.1000molL-1盐酸标准液应该使用 ______ 式滴定管,滴定时发生反应的离子方程式为: ______ 。
②有关数据记录如下:
测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.50 | 20.78 |
2 | 20.00 | 1.20 | 21.32 |
3 | 20.00 | 0.80 | 23.20 |
(3)计算:烧碱样品的纯度是 ______ 。
(4)误差分析(选填“偏高”“偏低”或“无影响”):
①用蒸馏水冲洗锥形瓶,则会使测定结果 ______ ;
②读数时,滴定前仰视,滴定后俯视,则会使测定结果 ______ 。
【答案】1000mL容量瓶 酸式 H++OH-=H2O 80.8% 无影响 偏低
【解析】
1)配制1000mL一定物质的量浓度的氢氧化钠溶液需要仪器:1000mL容量瓶、胶头滴管、烧杯、玻璃棒、天平、药匙,所以配制待测液需要的玻璃仪器有1000mL容量瓶、玻璃棒、胶头滴管,烧杯;
故答案为:1000mL容量瓶;
(2)盛装0.1000molL-1盐酸标准液应该使用酸式滴定管,反应的离子方程式为:H++OH-=H2O;
故答案为:酸式; H++OH-=H2O;
(3)三次消耗盐酸体积分别为:20.78mL-0.50mL=20.28mL、21.32mL-1.20mL=20.12mL、23.20mL-0.8mL=22.4mL(误差较大,舍去),两次消耗盐酸的平均体积为20.20mL,
NaOH~~~~~HCl
1 1
n(NaOH) 0.1000molL-1×20.20mL
n(NaOH)=0.00202mol,即20.00mL待测溶液含有m(烧碱)=nM=0.00202mol×40g/mol=0.0808g,所以1000mL待测溶液含有m(烧碱)=0.0808g×50=4.04g,烧碱的纯度ω(烧碱)=![]() ×100%=80.8%,
×100%=80.8%,
故答案为:80.8%;
(4)①用蒸馏水冲洗锥形瓶,不影响待测物的总物质的量,不会影响测定结果;
②读数时,滴定前仰视,滴定后俯视,盐酸体积变小,结果偏低;
故答案为:无影响;偏低;

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】某小组同学通过“FeSO4被HNO3氧化”的实验,验证Fe2+的还原性。
实验一:验证Fe2+的还原性
实验操作 | 预测现象 | 实验现象 |
向盛有2mLFeSO4溶液的试管中,滴入几滴浓硝酸,振荡 | 试管中产生红棕色气体,溶液变为黄色 | 试管中产生红棕色气体, 溶液变为深棕色 |
(1)红棕色气体是______________ (填化学式);
(2)实验现象与预期不符,继续进行实验。取深棕色溶液于试管中,滴加KSCN溶液,溶液变为血红色,该现象说明____________。
实验二:探究溶液变为深棕色的原因
〔资料与猜想〕查阅资料后猜想,可能是生成的NO2或者NO与溶液中的Fe2+或Fe3+反应,而使溶液变为深棕色。
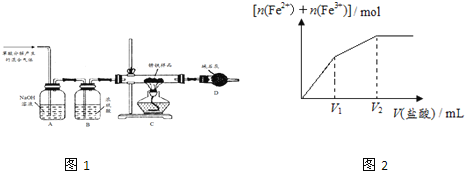
〔实验与探究〕用下图所示装置进行实验,步骤及现象如下:(装置的气密性已检验,尾气处理已略去)
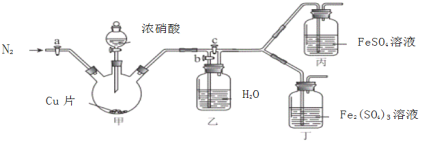
ⅰ关闭c,打开a和b,通入N2,一段时间后关闭a;
ⅱ向甲中加入适量浓HNO3,一段时间后丙中溶液变为深棕色,丁中溶液无明显变化;
ⅲ关闭b,打开c,更换丙、丁中的溶液(试剂不变);
ⅳ继续向甲中加入浓HNO3,一段时间后观察到了与ⅱ相同的实验现象。
根据以上实验步骤和实验现象回答下列问题:
(3)通入N2的目的是______________;
(4)铜与浓硝酸反应的化学方程式是_______________;
(5)装置乙的作用是_________________;
(6)实验结论是____________。