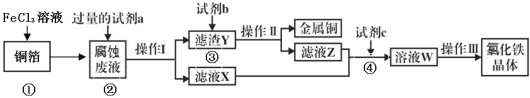
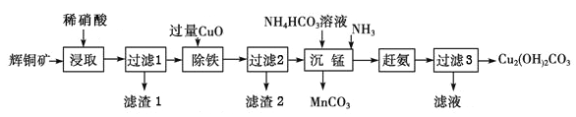
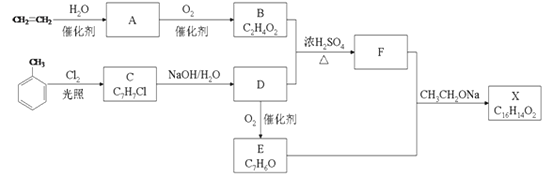
��Ŀ����
����Ŀ����֪������Ĺ���Ϊ��Fe��Fe��OH��2��Fe��OH��3��Fe2O3xH2O����֪���ᣨH2C2O4���ֽ�Ļ�ѧ����ʽΪ H2C2O4![]() CO��+CO2��+H2O��ij��ѧС��Ϊ�ⶨ���ֲ�ͬ������Ƭ����ɣ���ֻ��������Fe2O3xH2O��������������̽����������벢��ɶ��й�����Ľ��
CO��+CO2��+H2O��ij��ѧС��Ϊ�ⶨ���ֲ�ͬ������Ƭ����ɣ���ֻ��������Fe2O3xH2O��������������̽����������벢��ɶ��й�����Ľ��
��1����ͬѧ���ò���ֽ�����Ļ�����������ʾװ�òⶨ����һ����������ɡ�
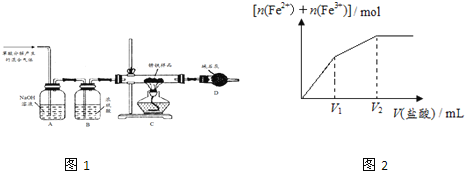
��Ҫ����Ϊ��ȡ������Ʒ12.6g����װ��C��Ӳ�ʲ������У�������ȫ��Ӧ��õ����������Ϊ8.4g��װ��D����8.4g��
�ٸ����ڳ�ʪ�����з����绯ѧ��ʴʱ���为���ĵ缫��ӦʽΪ ______ ��
��װ��A�������� ______ ��װ��B�������� ______ ��
�۸������������ܷ�ⶨ����������ɣ��� ______ ������������������������
�ܸ�װ�û����ڵ�һ�����Ե�ȱ���� ______ ��
��2����ͬѧ�ڼ�ͬѧװ�õĻ����Ͻ�װ��D����װŨ�����ϴ��ƿ��װ��E����װ��ͼ�ԣ������Ľ������°���ͬѧ�IJ�������Ʒȡ��������ʵ�飬����ȫ��Ӧ��õ������������Ϊ8.4g����װ��E����1.8g����x= ______ ��m��Fe����m ��Fe2O3xH2O��= ______ ��
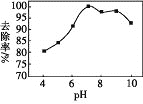
��3����ͬѧȡ����������һ������Ƭ�����ձ��У�Ȼ����μ���ϡ���ᣬʵ���֪������Һ��Fe2+��Fe3+�����ʵ���֮�������ϡ����������ϵ��ͼ2ʾ����������n��Fe����n��Fe2O3xH2O����ȡֵ��Χ�� ______ ��������ĸ��
a������1 b������1 c����1
���𰸡�Fe-2e-=Fe2+ ��ȥ��������е�CO2 ��ȥ��������е�H2O �� ȱ��β������װ�� 2 2��7 c
��������
����ֽ�õ���ˮ������CO��CO2�Ļ������Aװ���е�NaOH��ȥ������̼��Bװ���е�Ũ�������CO��Cװ����CO��ԭFe2O3��ͬʱFe2O3��xH2Oʧȥ�ᾧˮ��Dװ���м�ʯ������Cװ�������ɵ�CO2��H2O��g�����ݴ˷�������
��1���ٸ����ڳ�ʪ�����з����绯ѧ��ʴʱ��������ʧȥ���ӷ���������Ӧ�������ĵ缫��ӦʽΪFe-2e-=Fe2+��
�ʴ�Ϊ��Fe-2e-=Fe2+��
�ڸ���ʵ��Ŀ�ģ���Ҫʹ��һ����̼��ԭFe2O3��xH2O��������Ҫ������ֽ����ɵĶ�����̼��ˮ��ȥ��װ��A�е�����������Һ���ڳ�ȥ������̼���壬װ��B�е�Ũ�������ڸ���һ����̼���壬
�ʴ�Ϊ����ȥ��������е�CO2����ȥ��������е�H2O��
��������Ʒ12.6g��������ȫ��Ӧ��õ�������Ϊ8.4g�Ĺ���Ϊ������������������Ʒ����Ԫ�غ���Ԫ������֮��Ϊ12.6g-8.4g=4.2g����16g/mol��3n��Fe2O3��+18g/moln��H2O��=4.2g��װ��D����8.4gΪ������̼��ˮ����������Ϸ���ʽFe2O3��xH2O+3CO![]() 2Fe+3CO2+xH2O��44g/mol��3n��Fe2O3��+18g/moln��H2O��=8.4g�����n��Fe2O3��=0.05mol��n��H2O��=0.1mol����Fe2O3��xH2O�Ļ�ѧʽΪFe2O3��2H2O��������Ʒ�к�n��Fe2O3��2H2O��=0.05mol����n��Fe��=
2Fe+3CO2+xH2O��44g/mol��3n��Fe2O3��+18g/moln��H2O��=8.4g�����n��Fe2O3��=0.05mol��n��H2O��=0.1mol����Fe2O3��xH2O�Ļ�ѧʽΪFe2O3��2H2O��������Ʒ�к�n��Fe2O3��2H2O��=0.05mol����n��Fe��=![]() =0.05mol���ܲⶨ��������ɣ�
=0.05mol���ܲⶨ��������ɣ�
�ʴ�Ϊ���ܣ�
�ܸ�װ�õ�ȱ���ǣ�һ����̼�ж��������ŷŵ������У�����Ӧ������β������װ�ã�
�ʴ�Ϊ��ȱ��β������װ�ã�
��2������װ��D����װŨ�����ϴ��ƿ��װ��E�������°�������Ʒ�������Ͳ�������ʵ�飬����ȫ��Ӧ��õ������������Ϊ8.4g����������Ʒ����Ԫ�غ���Ԫ������֮��Ϊ12.6g-8.4g=4.2g��16g/mol��3n��Fe2O3��+18g/moln��H2O��=4.2g��װ��E����1.8g��n��H2O��=1.8g��18g/mol=0.1mol�����n��Fe2O3��=0.05mol��n��Fe2O3����n��H2O��=0.05mol��0.1mol=1:2����x=2��m��Fe2O3��xH2O��=0.05mol��160g/mol+1.8g=9.8g��m��Fe��=12.6g-9.8g=2.8g��m��Fe����m ��Fe2O3xH2O��= 2.8g��9.8g=2:7��
�ʴ�Ϊ��2��2��7��
��3��0��V1�Σ�������������ʱ�������ķ�ӦΪFe2O3+6HCl=2FeCl3+3H2O��Fe+2FeCl3=3FeCl2���ܷ�ӦΪ��Fe+Fe2O3+6HCl=3FeCl2+3H2O����Fe+2HCl=FeCl2+H2����֪��2mol�Ȼ�������1mol�������ӣ���Fe2O3+6HCl=2FeCl3+3H2O��֪��6mol���Ȼ����������2mol��Fe3+����Ȼ������ͬ���ʵ�������ʱ���������ᷴӦ���ӵ������������ʵ����������������ᷴӦ���ӵ����������ʵ���������V1��V2�����Ӻ����������ܵ����ʵ����������С��0��V1��˵��V1��V2��Ϊ������������ķ�Ӧ���������������ʵ��������������ʵ�������c��ȷ��
�ʴ�Ϊ��c��

 �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�����Ŀ�����к͵ζ����ⶨij�ռ���Ʒ�Ĵ��ȣ������²��裺
��1�����ƴ���Һ����5.00g�����������ʣ����ʲ������ᷴӦ���Ĺ����ռ���Ʒ����1000mL��Һ�����ձ�����ͷ�ιܡ��������⣬����Ҫ�IJ��������� ______ ��
��2�����
��ʢװ0.1000molL-1�����ҺӦ��ʹ�� ______ ʽ�ζ��ܣ��ζ�ʱ������Ӧ�����ӷ���ʽΪ�� ______ ��
���й����ݼ�¼���£�
�ⶨ��� | ������Һ�����/mL | ���������Һ�����/mL | |
�ζ�ǰ | �ζ��� | ||
1 | 20.00 | 0.50 | 20.78 |
2 | 20.00 | 1.20 | 21.32 |
3 | 20.00 | 0.80 | 23.20 |
��3�����㣺�ռ���Ʒ�Ĵ����� ______ ��
��4����������ѡ����ƫ������ƫ����������Ӱ��������
��������ˮ��ϴ��ƿ�����ʹ�ⶨ��� ______ ��
�ڶ���ʱ���ζ�ǰ���ӣ��ζ����ӣ����ʹ�ⶨ��� ______ ��