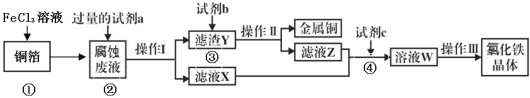
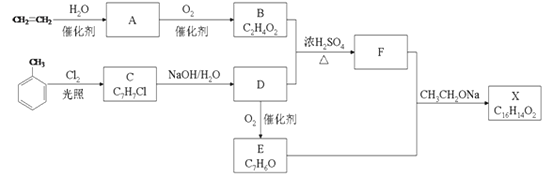
题目内容
【题目】含有O22-的物质通常接有较强的氧化化性,一定条件下也可表现出还原性等,在现代工业及生活中有着重要的用途。
(1)过氧化钙可用作鱼苗长途运输中的供氧剂、消毒剂,写出过氧化钙的电子式:______,用化学方程式表示出它作供氧剂的原理:______。
(2)过氧化氢能氧化许多物质,也能被多种常见物质催化分解。
①向20mL0.05molL-1的H2O2溶液中缓慢通入标准状况下22.4mLSO2(忽略溶液体积的变化),充分反应后再加入几滴甲基橙试剂,溶液变红,则反应后溶液的pH为______。
②为证明MnO2能催化H2O2的分解,同学甲设计了如图所示的装置进行实验:
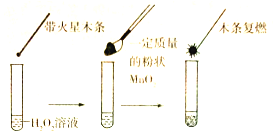
但乙同学认为,仅凭此实验不能确认MnO2是该反应的催化剂,他作出此判断的理由可能是______。
③FeCI3可催化H2O2的分解,其催化机理分为两个阶段,相应反应的化学方程式可表示为:
(i)2FeCl3+H2O2=2FeCl2+O2↑+2HCl。
(ii)______。
若在实验中加入几滴______,则能证明反应过程中确有Fe2+生成。
(3)过硫酸钠(Na2S2O8,有一个过氧根)其有强氧化性,Na2S2O8中硫元素的化合价为______,向Na2S2O8溶液中加入MnSO4后可得到紫色溶液,则此反应中氧化剂与氧化产物的物质的量之比为______。
【答案】![]() 2CaO2+2H2O=2Ca(OH)2+O2↑ 1 若要确定二氧化锰是催化剂,还需要确定加入的二氧化锰在反应前后质量不变、化学性质不变 2FeCl2+H2O2+2HCl=2FeCl3+2H2O K3[Fe(CN)6]溶液 +6 5:2
2CaO2+2H2O=2Ca(OH)2+O2↑ 1 若要确定二氧化锰是催化剂,还需要确定加入的二氧化锰在反应前后质量不变、化学性质不变 2FeCl2+H2O2+2HCl=2FeCl3+2H2O K3[Fe(CN)6]溶液 +6 5:2
【解析】
(1)模仿Na2O2书写CaO2的电子式和CaO2与水反应的方程式;
(2)根据H2O2能氧化许多物质,以及一定条件下也可表现还原性分析;
(3)结合题给信息以及化合物中元素的正负化合价代数和为0,氧化还原反应中得失电子守恒分析。
(1)过氧化钙(CaO2)为离子化合物,其电子式为:![]() ;过氧化钙与水反应与过氧化钠与水反应相似,生成氢氧化钙与氧气,反应的化学方程式为:2CaO2+2H2O=2Ca(OH)2+O2↑,故答案为:
;过氧化钙与水反应与过氧化钠与水反应相似,生成氢氧化钙与氧气,反应的化学方程式为:2CaO2+2H2O=2Ca(OH)2+O2↑,故答案为:![]() ;2CaO2+2H2O=2Ca(OH)2+O2↑;
;2CaO2+2H2O=2Ca(OH)2+O2↑;
(2)①加入几滴甲基橙试剂,溶液变红,说明生成了酸,所以反应的方程式为:SO2+H2O2=H2SO4,20mL0.05molL-1的H2O2的物质的量为:10-3mol,缓慢通入标准状况下22.4mLSO2的物质的量为:10-3mol,所以生成硫酸的物质的量为:10-3mol,硫酸物质的量浓度为![]() mol/L=0.05mol/L,则氢离子的浓度为0.1mol/L,即pH=1,故答案为:1;
mol/L=0.05mol/L,则氢离子的浓度为0.1mol/L,即pH=1,故答案为:1;
②催化剂能改变化学反应速率,但本身的质量和化学性质在反应前后不变;而本实验只能说明双氧水中加入二氧化锰后有氧气生成,若要确定二氧化锰是催化剂,还需要确定加入的二氧化锰在反应前后质量不变、化学性质不变,故答案为:若要确定二氧化锰是催化剂,还需要确定加入的二氧化锰在反应前后质量不变、化学性质不变;
③催化剂参与反应过程、但在反应前后质量和化学性质不变,故第二个反应为过氧化氢将氯化亚铁氧化成氯化铁,反应的化学方程式为:2FeCl2+H2O2+2HCl=2FeCl3+2H2O;可用K3[Fe(CN)6]来检验反应过程中的亚铁离子的存在,若加入K3[Fe(CN)6]溶液出现蓝色沉淀,则含有Fe2+;故答案为:2FeCl2+H2O2+2HCl=2FeCl3+2H2O;K3[Fe(CN)6]溶液;
(3)Na2S2O8中2个O为-1价,6个O为-2价,Na为+1价,根据化合物中元素的正负化合价代数和为0,Na2S2O8中硫元素的化合价为+6价;由题意可知,锰离子氧化成高锰酸根离子,Mn2+为还原剂,S2O82-中过氧根被还原为-2价氧后,S2O82-会转化为硫酸根,反应中Na2S2O8是氧化剂,1molNa2S2O8可得到2mol的电子,高锰酸根离子是氧化产物,1molMn2+生成1mol的高锰酸根离子时失去5mol的电子,故氧化剂与氧化产物的物质的量之比为5:2,故答案为:+6;5:2。

【题目】用中和滴定法测定某烧碱样品的纯度.有以下步骤:
(1)配制待测液:用5.00g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液,除烧杯、胶头滴管、玻璃棒外,还需要的玻璃仪器有 ______ 。
(2)滴定:
①盛装0.1000molL-1盐酸标准液应该使用 ______ 式滴定管,滴定时发生反应的离子方程式为: ______ 。
②有关数据记录如下:
测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.50 | 20.78 |
2 | 20.00 | 1.20 | 21.32 |
3 | 20.00 | 0.80 | 23.20 |
(3)计算:烧碱样品的纯度是 ______ 。
(4)误差分析(选填“偏高”“偏低”或“无影响”):
①用蒸馏水冲洗锥形瓶,则会使测定结果 ______ ;
②读数时,滴定前仰视,滴定后俯视,则会使测定结果 ______ 。