题目内容
【题目】某溶液X含有H+、Al3+、NH4+、Fe2+、Fe3+、HCO3-、S2-、SO42-、Cl-、OH-中的一种或几种,取该溶液进行实验,实验内容和相关数据(气体体积在标准状况下测定)如下:
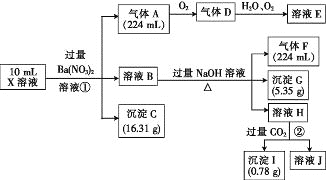
(1)通过上述实验过程,一定不存在的离子是_______。
(2)反应①中生成A的离子方程式为________。
(3)若测得X溶液中c(H+)=6mol·L-1,则X溶液中_______(填“含”或“不含”)Fe3+,c(Fe3+)=________mol·L-1(若填不含,则不需计算),X溶液中c(Cl-)=_______mol·L-1。
【答案】HCO3-、S2-、OH- 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 含 2 8
【解析】
测得X溶液中c(H+)=6mol/L,在强酸性溶液中与H+反应的离子不能大量存在;一定不会存在HCO3-、S2-、OH-离子,加入过量硝酸钡生成沉淀,则沉淀C为BaSO4 沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E 为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量 NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中溶于 CO2气体,生成沉淀I,则I为Al(OH)3,H为NaAlO2,沉淀G为Fe(OH)3,说明原溶液中含有Al3+离子,通过计算氢氧化铁物质的量和原溶液中亚铁离子物质的量判断原溶液中含有Fe3+,溶液显酸性,溶液中含有Fe2+离子,就一定不含NO3-离子,根据已知溶液中电荷守恒计算确定是否含有的离子Cl-,以此解答。
通过上述分析可知:气体A是NO,溶液B中含有Al3+、NH4+、Fe2+,沉淀C是BaSO4,气体D是NO2,溶液E为HNO3,气体F是NH3,I为Al(OH)3,H为NaAlO2,沉淀G为Fe(OH)3:
(1)由于测得X溶液中c(H+)=6mol/L,溶液显酸性,在强酸性溶液中与H+反应的离子HCO3-、S2-、OH-不能大量存在;故原溶液一定不会存在HCO3-、S2-、OH-离子;
(2)在X中含有Fe2+、H+,当加入Ba(NO3)2溶液时,会发生氧化还原反应,产生Fe3+、NO、H2O,反应的离子方程式:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(3)n(NO)=0.224L÷22.4L/mol=0.01mol,根据3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O中Fe2+与NO的关系可知n(Fe2+)=3n(NO)=0.03mol,n[Fe(OH)3]=5.35g÷107g/mol=0.05mol>n(Fe2+)=0.03mol,根据Fe元素守恒,说明在原溶液中含有Fe3+,其物质的量是0.02mol,由于溶液的体积是0.01L,所以c(Fe3+)=0.02mol÷0.01L=2mol/L;该溶液中,n(H+)=6mol/L×0.01L=0.06mol,根据元素守恒可得n(NH4+)=n(NH3)=0.224L÷22.4L/mol=0.01mol,n(SO42-)=n(BaSO4)=16.31g÷233g/mol=0.07mol,n(Al3+)=n[Al(OH)3]=0.78g÷78g/mol=0.01mol,根据(3)计算可知n(Fe2+)=0.03mol,n(Fe3+)=0.02mol,由于正电荷总数:3n(Al3+)+ 3n(Fe3+)+2n(Fe2+)+ n(NH4+)+ n(H+)=3×0.01mol+3×0.02mol+2×0.03mol+0.01mol+0.06mol=0.22mol,n(SO42-)=0.07mol,其所带的负电荷数0.07mol×2=0.14mol<0.22mol,所以该溶液中还含有带负电荷的Cl-,其物质的量为n(Cl-)=0.22mol-0.14mol=0.08mol,其物质的量浓度c(Cl-)=0.08mol÷0.01L=8mol/L。

【题目】芳香族羧酸通常用芳香烃的氧化来制备。芳香烃的苯环比较稳定,难于氧化,而环上的支链不论长短,在强烈氧化时,最终都氧化成羧基。某同学用甲苯的氧化反应制备苯甲酸 。反应原理:
![]() +2KMnO4
+2KMnO4 ![]() +KOH+2MnO2 +H2O
+KOH+2MnO2 +H2O
![]() +HCl
+HCl![]() +KCl
+KCl
反应试剂、产物的物理常数:
名称 | 相对分 子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
水 | 乙醇 | 乙醚 | ||||||
甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 易溶 | 易溶 |
苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
主要实验装置和流程如下:
下图回流搅拌装置
下图抽滤装置

实验方法:一定量的甲苯和KMnO4溶液置于图1装置中,在90℃时, 反应一段时间,再停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯。
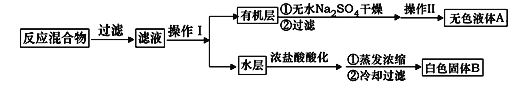
(1)无色液体A的结构简式为___________。操作Ⅱ为__________。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,加亚硫酸氢钾的目的是______。
(3)下列关于仪器的组装或者使用正确的是__________。
A.抽滤可以加快过滤速度,得到较干燥的沉淀
B.安装电动搅拌器时,搅拌器下端不能与三颈烧瓶底、温度计等接触
C.回流搅拌装置应采用直接加热的方法
D.冷凝管中水的流向是下进上出
(4)除去残留在苯甲酸中的甲苯应先加入__________,分液,水层再加入__________,然后抽滤,干燥即可得到苯甲酸。
(5)纯度测定:称取1.220g产品,配成100ml溶液,取其中25.00ml溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3mol。产品中苯甲酸质量分数为______________。
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应