题目内容
10.往100mL氢离子浓度为1mol•L-1的硫酸和硝酸混合液中投入3.84g铜粉,微热使反应充分完成后,生成NO气体448mL(标准状况).则反应前的混合液中含硫酸的物质的量为( )| A. | 0.01mol | B. | 0.02 mol | C. | 0.03 mol | D. | 0.04 mol |
分析 100mL氢离子浓度为1mol•L-1的混合液中含有氢离子的物质的量为:n(H+)=0.1L×1mol/L=0.1mol,3.84g铜粉物质的量为:$\frac{3.84g}{64g/mol}$=0.06mol,NO的物质的量为:$\frac{0.448L}{22.4L/mol}$=0.02mol,根据3Cu+8H++2NO3-=3Cu2++2NO↑+3H2O可知,铜、H+过量,所以只能是硝酸不足,进而可计算出硝酸的物质的量,再根据氢离子的物质的量计算出硫酸的物质的量.
解答 解:100mL氢离子浓度为1mol•L-1的混合液中含有氢离子的物质的量为:n(H+)=0.1L×1mol/L=0.1mol,
3.84g铜粉物质的量为:$\frac{3.84g}{64g/mol}$=0.06mol,NO的物质的量为:$\frac{0.448L}{22.4L/mol}$=0.02mol,
根据3Cu+8H++2NO3-=3Cu2++2NO↑+3H2O可知,生成0.02molNO,需要铜0.03mol、H+为0.04mol,所以铜、H+过量,硝酸不足,硝酸完全反应,
根据氮元素守恒可知,溶液中n(HNO3)=n(NO)=0.02mol,0.02mol硝酸中含有0.02mol氢离子,则硫酸中含有的氢离子的物质的量为:0.1mol-0.02mol=0.08mol,则硫酸的物质的量为:$\frac{1}{2}$×0.08mol=0.04mol,
故选D.
点评 本题考查混合物反应的计算,题目难度中等,根据离子方程式及题中数据正确判断硝酸不足为解答关键,注意掌握质量守恒定律在化学计算中的应用方法.

练习册系列答案
相关题目
20.下列反应的离子方程式正确( )
| A. | 铜与稀硝酸反应 Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O | |
| B. | 稀碳酸钠溶液中通入二氧化碳 CO32-+CO2+H2O=2HCO3- | |
| C. | 在氯化铝溶液中滴入氨水 Al3++4NH3•H2O=AlO2-+4NH4+ | |
| D. | 向次氯酸钙溶液中通入SO2 Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO |
1.某无色溶液中可能含有H+、OH-、K+、NO3-,加入铝粉后,只产生H2.试回答:
(1)加入铝粉产生H2,说明铝具有还原性(填“氧化性”或“还原性”).
(2)甲同学分析:若H+大量存在,则NO3-就不能大量存在.设计实验证实如表:
①盐酸溶解Al2O3薄膜的离子方程式是6H++Al2O3═2Al3++3H2O.
②根据现象Ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
a.浅棕色气体是NO2.
b.实验1的目的是对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能.
c.实验1、2说明反应生成了NO,写出该反应的离子方程式:Al+NO3?+4H+═Al3++NO↑+2H2O.
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在.重新设计实验证实如表:
为确认“刺激性气味”气体,进行如下实验:用湿润KI-淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝. 则:
①刺激性气味的气体是NH3.
②产生该气体的离子方程式是8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-.
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成.实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物.因此无色溶液一定能大量存在的是K+、OH-.
(1)加入铝粉产生H2,说明铝具有还原性(填“氧化性”或“还原性”).
(2)甲同学分析:若H+大量存在,则NO3-就不能大量存在.设计实验证实如表:
| 装 置 | 现 象 |
 | Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,液面上方呈浅棕色 Ⅲ.试管变热,溶液沸腾 |
②根据现象Ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
| 实 验 | 内 容 | 现 象 |
| 实验1 | 将湿润KI-淀粉试纸置于空气中 | 未变蓝 |
| 实验2 | 用湿润KI-淀粉试纸检验浅棕色气体 | 试纸变蓝 |
b.实验1的目的是对比实验,排除氧气使湿润的淀粉KI试纸变蓝的可能.
c.实验1、2说明反应生成了NO,写出该反应的离子方程式:Al+NO3?+4H+═Al3++NO↑+2H2O.
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在.重新设计实验证实如表:
| 装置 | 现象 |
 | Ⅰ.实验初始,未见明显现象 Ⅱ.过一会儿,出现气泡,有刺激性气味 |
①刺激性气味的气体是NH3.
②产生该气体的离子方程式是8Al+3NO3-+5OH-+2H2O═3NH3↑+8AlO2-.
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成.实验结果证实:NO3?在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物.因此无色溶液一定能大量存在的是K+、OH-.
18.下列反应属于加成反应的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 2C6H6+15O2$\stackrel{点燃}{→}$12CO2+6H2O |
2.铁镍蓄电池,放电时的总反应为:Fe+Ni2O3+3H2O $?_{充电}^{放电}$ Fe(OH)2+2Ni(OH)2下列有关该电池的说法正确的是( )
| A. | 电池的电解液为碱性溶液,负极为Ni2O3、正极为Fe | |
| B. | 电池放电时,阴极反应为Fe+2OH--2e-═Fe(OH)2 | |
| C. | 电池充电过程中,阴极附近溶液的pH降低 | |
| D. | 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O |
19.三聚氰酸C3N3(OH)3可用于消除汽车尾气中的氮氧化物.当加热至一定温度时,它分解产生的HNCO(异氰酸,其结构是H-N=C=O)能和NO2反应:HNCO+NO2$\stackrel{△}{→}$N2+CO2+H2O(未配平).下列关于该反应的叙述正确的是( )
| A. | N2是还原产物,CO2是氧化产物 | |
| B. | 每生成22.4LCO2需转移3 mol电子 | |
| C. | 反应中氧化剂和还原剂的物质的量之比为4:3 | |
| D. | N元素既被氧化,也被还原 |
20.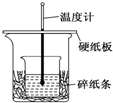 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )
某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )
 某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )
某实验小组学生用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量计算反应热,下列说法正确的是( )| A. | 如图条件下实验过程中没有热量损失 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是固定小烧杯 | |
| D. | 若改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L的NaOH溶液进行反应,理论上所求反应热偏高 |
 E的电子式为
E的电子式为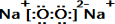 ;
;