题目内容
10.硼元素、钙元素、铜元素在化学战有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.(1)已知CaC2与水反应生成乙炔.请回答下列问题:
①将乙炔通入[Cu(NH3)2]Cl榕液中生成Cu2C2红棕色沉淀,Cu+基态核外电子排布式为1s22s22p63s23p63d10.
②CaC2中C22-与O22+互为等电子体.1molO22+中含有的π键数目为2NA.
③乙炔与氢氰酸反应可得丙烯睛(H2C一CH一C=N).丙烯腈分子中碳原子轨道杂化类
型是sp、sp2,构成丙烯腈元素中第一电离能最大的是N.
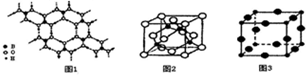
(2)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢键相连(如图1〕.则1 mo1H3BO3的晶体中有3mol氢键.硼酸溶于水生成弱电解质一水合硼酸
B(OH)3•H2O,它电离生成少盆[B(OH)4]一和H+,则[B(OH)4]一的空间构型为正四面体型
(3)某M原子的外围电子排布式为3S23P5,铜与M形成化合物的晶胞如图2所示(黑点代表铜原子,空心圆代表M原子).
①该晶体化学式为CuCl.
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于共价(填“离子”、“共价”)化合物.
(3)Cu3N的晶胞结构如图3,N3-的配位数为6.Cu+半径为a pm,N3-半径为bpm,Cu3N的密度为$\frac{103×1{0}^{-30}}{4(a+b)^{3}{N}_{A}}$g•cm一3.(阿伏加德罗常数用NA表示)
分析 (1)①Cu为29号元素,根据电子排布式的书写方法来解答;
②根据等电子体的结构相似,则O22+中含有三键,根据三键中有2个π键来计算;
③丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,故碳原子的杂化轨道类型为sp和sp2杂化;越易失去一个电子,则第一电离能越大;
(2)利用均摊法计算含1molH3BO3的晶体中的氢键;[B(OH)4]-中B原子的价层电子对数分析;
(3)根据价电子排布式判断出M原子为Cl原子;
①晶胞中含有4个Cu原子,Cl原子位于顶点与面心上,利用均摊法计算得出;
②根据电负性差值判断化合物类型;
(4)该晶胞中大球个数=12×$\frac{1}{4}$=3,小球个数=8×$\frac{1}{8}$=1,根据其化学式知,小球为N3-、大球为Cu+,N3-的配位数为6,该晶胞棱长=(2a+2b)pm=(2a+2b)×10-10cm,晶胞体积=(2a+2b)3×10-30cm3,晶胞密度=$\frac{m}{V}$.
解答 解:(1)①Cu为29号元素,3d轨道有10个电子,4s轨道有1个电子,Cu原子失去最外层电子形成Cu+,Cu+的基态电子排布式为1s22s22p63s23p63d10,
故答案为:1s22s22p63s23p63d10;
②等电子体的结构相似,则O22+中含有三键,所以在1个O22+含有2个π键,故1 mol O22+中,含有2NA个π键,故答案为:2NA;
③丙烯腈(H2C=CH-C≡N)中的C分别形成2个δ键和3个δ键,故碳原子的杂化轨道类型为sp和sp2杂化;越易失去一个电子,则第一电离能越大,H2C=CH-C≡N中N元素最难失去电子,则N的第一电离能最大,故答案为:sp、sp2;N;
(2)一个H3BO3分子对应着6个氢键,一个氢键对应着2个H3BO3分子,因此含有1 molH3BO3分子的晶体中有3mol氢键,[B(OH)4]-中B原子形成4个共价键,则B原子的价层电子对数为4,为sp3杂化,没有孤电子对,空间结构为正四面体型;
故答案为:3;正四面体型;
(3)M原子的外围电子排布式为3S23P5,M原子为Cl原子,则
①由晶胞结构可知,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,Cl原子位于顶点与面心上,晶胞中含有Cl原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故化学式为CuCl,
故答案为:CuCl;
②电负性差值大于1.7原子间易形成离子键,小于1.7原子间形成共价键,铜与X的电负性分别为1.9和3.0,差值为1.1小于1.7,形成共价键,
故答案为:共价;
(4)该晶胞中大球个数=12×$\frac{1}{4}$=3,小球个数=8×$\frac{1}{8}$=1,根据其化学式知,小球为N3-、大球为Cu+,N3-的配位数为6,该晶胞棱长=(a+b)pm=(2a+2b)×10-10cm,晶胞体积=(2a+2b)3×10-30cm3,晶胞密度=$\frac{m}{V}$=$\frac{\frac{206}{{N}_{A}}×1}{(2a+2b)^{3}×1{0}^{-30}}$g•cm-3=$\frac{103×1{0}^{-30}}{4(a+b)^{3}{N}_{A}}$g•cm-3,
故答案为:6;$\frac{103×1{0}^{-30}}{4(a+b)^{3}{N}_{A}}$.
点评 本题考查较为综合,题目难度中等,涉及电子排布式、第一电离能、晶胞的计算、杂化类型的判断、氢键等知识点,对学生的空间想象有一定要求,侧重考查学生对知识的迁移应用,注意信息的理解和综合应用.

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案| A. | Na2O、Na2O2组成元素相同,均与H2O反应,均属于碱性氧化物 | |
| B. | 新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈无色 | |
| C. | NO、SO2、NO2都是大气污染气体,在空气中都不能稳定存在 | |
| D. | SiO2是酸性氧化物,能与NaOH溶液反应 |
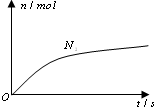 某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )
某离子反应中涉及H2O、ClO-、NH4+、H+、N2、Cl-六种微粒.其中N2的物质的量随时间变化的曲线如右图所示.则下列判断正确的是( )| A. | 反应后溶液的酸性明显增强 | |
| B. | 消耗1 mol还原剂,转移6 mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 该反应的还原剂是Cl- |
| 不纯物质 | 除杂试剂 | 分离方法 | |
| A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 苯(Br2) | KOH溶液 | 分液 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 某些花岗石产生氡(${\;}_{86}^{222}$Rn),从而对人体产生伤害,${\;}_{86}^{222}$Rn的质量数是222 | |
| B. | Se是人体必需的微量元素,${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素,是两种不同的核素 | |
| C. | ${\;}_{92}^{235}$U的浓缩一直被国际社会关注,其中子数和质子数之差为51 | |
| D. | 113号元素属于过渡元素 |
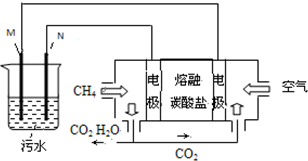 工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.
工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.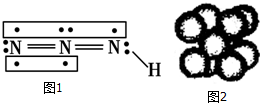 叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N3-.
叠氮化物是一类重要化合物,氢叠氮酸(HN3)是一种弱酸,如图为分子结构示意图1.肼(N2H4)被亚硝酸氧化时便可生成氢叠氮酸(HN3):N2H4+HNO2═2H2O+HN3.它的酸性类似于醋酸,可微弱电离出H+和N3-.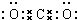 .
.
 ;
;