题目内容
5.下列各项叙述中,正确的是( )| A. | N、P、As的电负性随原子序数的增大而增大 | |
| B. | 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素 | |
| C. | 2p和3p轨道形状均为纺锤形,能量也相等 | |
| D. | 氮原子的最外层电子的轨道表示式: |
分析 A.同主族元素,从上到下电负性减弱;
B.价电子排布为4s24p3的元素有4个电子层、最外层电子数为5,最后填充p电子;
C.离原子核越远,能量越高;
D.由洪特规则可知,电子优先占据1个轨道,且自旋方向相同.
解答 解:A.同主族元素从上到下,电负性减小,则N、P、As的电负性随原子序数的增大而减小,故A错误;
B.价电子排布为4s24p3的元素有4个电子层、最外层电子数为5,位于第四周期第ⅤA族,最后填充p电子,是p区元素,故B正确;
C.p轨道均为纺锤形,离原子核越远,能量越高,2p轨道能量低于3p,故C错误;
D.利用“洪特规则”可知最外层电子排布图错误,应为 ,故D错误;
,故D错误;
故选B.
点评 本题考查原子核外电子的排布、电负性,把握电子排布规律及电子排布与元素位置的关系即可解答,注意规律性知识的总结和应用,题目难度不大.

练习册系列答案
 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
8.如图是部分短周期主族元素原子半径与原子序数的关系图.下列说法不正确的是( )


| A. | 离子半径:d3+<f- | |
| B. | 原子失电子能力:c>d | |
| C. | 最简单气态氢化物的热稳定性:a<e | |
| D. | b、c两元素可组成既含离子键又含共价键的化合物 |
10.通常状况下,NCl3是一种油状液体,其分子空间构型与氨分子相似,下列对NCl3的有关叙述正确的是( )
| A. | NCl3分子中N-Cl键的键长比CCl4分子中C-Cl键的键长长 | |
| B. | NCl3分子是非极性分子 | |
| C. | 分子中的所有原子均达到8电子稳定结构 | |
| D. | NCl3不含孤电子对 |
14.下列选项中,都是只由极性键形成的非极性分子的一组物质是( )
| A. | BCl3、CS2、SO3 | B. | CH4、CH2Cl2、BeCl2 | ||
| C. | P4、SiO2、CO2 | D. | NF3、CCl4、苯(C6H6) |
15.提纯下列物质(括号内为杂质),选用的除杂试剂与分离方法正确的是( )
| 不纯物质 | 除杂试剂 | 分离方法 | |
| A | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 苯(Br2) | KOH溶液 | 分液 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
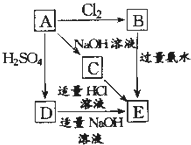 在如图式中,E是不溶于水的白色胶状物质,试推断:
在如图式中,E是不溶于水的白色胶状物质,试推断: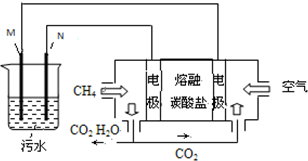 工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.
工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.