题目内容
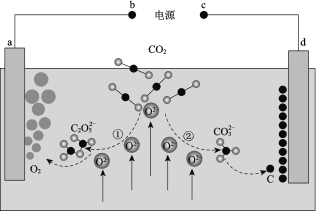
【题目】二氧化硫是形成酸雨的罪魁祸首之一,含硫煤燃烧的尾气处理一直是化学研究的重要课题。某工厂设计了新的治污方法,该工艺流程如图所示,下列叙述不正确的是( )

A.该过程中可得到化工产品![]()
B.该工艺流程中![]() 可以循环利用
可以循环利用
C.若处理含![]() 的尾气,理论上需要通入相同条件下的空气约
的尾气,理论上需要通入相同条件下的空气约![]()
D.可用澄清石灰水检验最终排出的气体是否含有二氧化硫
【答案】D
【解析】
根据工艺流程所示可知,该工艺中Fe2(SO4)3和H2O吸收SO2生成FeSO4和H2SO4,该反应的化学方程式为Fe2(SO4)3+2H2O+SO2=2FeSO4+2H2SO4,据此分析解答。
A.分析流程,![]() 最终转化为
最终转化为![]() ,故该过程中可得到化工产品
,故该过程中可得到化工产品![]() ,故A正确;
,故A正确;
B.![]() 与
与![]() 反应生成
反应生成![]() ,然后
,然后![]() 被氧化为
被氧化为![]() ,故该工艺流程中
,故该工艺流程中![]() 可以循环利用,故B正确;
可以循环利用,故B正确;
C.根据2SO2+O2 3SO3,若处理含![]() 的尾气,理论上需要相同条件下的氧气
的尾气,理论上需要相同条件下的氧气![]() ,氧气在空气中的体积分数约为
,氧气在空气中的体积分数约为![]() ,理论上需要通入相同条件下的空气约
,理论上需要通入相同条件下的空气约![]() ,故C正确;
,故C正确;
D.煤燃烧生成二氧化碳,最终排出的气体一定含有二氧化碳,也能使石灰水变浑浊,故D错误。
答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目