题目内容
【题目】2020年2月15日,由国家科研攻关组的主要成员单位的专家组共同研判磷酸氯喹在细胞水平上能有效抑制新型冠状病毒(SARS-CoV-2)的感染。磷酸氯喹的结构如图所示,据此回答下列问题。
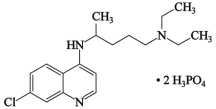
(1)C、N、O三种元素第一电离能从大到小的顺序为_____________;电负性χ(P)_____χ(Cl)(填“>”或“<”);
(2)磷酸氯喹中N原子的杂化方式为_____,NH3是一种极易溶于水的气体,其沸点比AsH3的沸点高,其原因是___________;
(3)磷化镓与砷化镓是两种由ⅢA族元素与ⅤA族元素人工合成的Ⅲ-Ⅴ族化合物半导体材料。其晶胞结构可看作金刚石晶胞内部的碳原子被P(As)原子代替,顶点和面心的碳原子被Ga原子代替。
①基态Ga原子核外电子排布式为__________;
②砷化镓晶体中含有的化学键类型为___________(填选项字母);
A.离子键 B.配位键 C.σ键 D.π键 E.极性键 F.非极性键
③磷化镓与砷化镓具有相似的晶体结构,其中熔点较高的是__________(填化学式),原因是_______________;
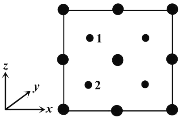
④以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置。称作原子分数坐标。如图为沿y轴投影的磷化镓晶胞中所有原子的分布图。若原子1的原子分数坐标为(0.25,0.25,0.75),则原子2的原子分数坐标为__________;若磷化镓的晶体密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶胞中Ga和P原子的最近距离为__________ pm(用代数式表示)。
【答案】N>O>C < sp2、sp3 NH3中N的电负性比AsH3中As的大得多,故NH3易形成分子间氢键,从而使其沸点升高;也容易与H2O形成分子间氢键,使其在水中溶解度增大 1s22s22p63s23p63d104s24p1 BCE GaP 二者均为共价晶体,P原子半径小于As,P-Ga键长小于As-Ga键长,GaP键能更大,熔点更高 (0.25,0.25,0.25) 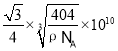
【解析】
(1)同一周期元素第一电离能随着原子序数增大而呈增大趋势,但是第IIA族、第VA族第一电离能大于其相邻元素;根据P和Cl的非金属性分析判断电负性;
(2)磷酸氯喹中N原子有两种情况,价层电子对数分别是3、4,根据价层电子对互斥理论判断N原子轨道类型;NH3分子之间形成氢键,NH3也容易与H2O形成分子间氢键,据此分析解答;
(3)①Ga为31号元素,位于第四周期第ⅢA族,据此分析解答;
②金刚石晶胞内部的碳原子数为4,顶点和面心的碳原子为4,所以磷化镓晶体为原子晶体,每个P与4个Ga以单键相连,每个Ga也与4个P以单键相连,而P最外层有5个电子、Ga最外层有3个电子,只能形成三对共用电子对,它们之间有四个共价键,所以有一个配位键,据此分析判断;
③二者都是原子晶体,砷的原子半径大于磷,据此分析解答;
④P原子1和P原子2及其对称的另外两个P原子为正四面体结构,根据投影图可知晶胞在三维坐标的位置如图 ,晶胞顶点Ga原子与四面体中心P原子连线的距离等于体对角线长度的
,晶胞顶点Ga原子与四面体中心P原子连线的距离等于体对角线长度的![]() ,据此分析计算。
,据此分析计算。
(1)同一周期元素第一电离能随着原子序数增大而呈增大趋势,但是第IIA族、第VA族第一电离能大于其相邻元素,所以第一电离能N>O>C;P的非金属性小于氯,电负性:P<Cl,故答案为:N>O>C;<;
(2)磷酸氯喹中N原子有两种情况,价层电子对数分别是3、4,N原子杂化类型分别为sp2、sp3;NH3分子间能形成氢键,而AsH3分子间不能形成氢键,所以NH3沸点高,NH3也容易与H2O形成分子间氢键,使其在水中溶解度增大,故答案为:sp2、sp3;NH3中N的电负性比AsH3中As的大得多,故NH3易形成分子间氢键,从而使其沸点升高;也容易与H2O形成分子间氢键,使其在水中溶解度增大;
(3)①Ga为31号元素,位于第四周期第ⅢA族,基态Ga原子核外电子排布式为1s22s22p63s23p63d104s24p1,故答案为:1s22s22p63s23p63d104s24p1;
②金刚石晶胞内部的碳原子数为4,顶点和面心的碳原子为4,所以磷化镓晶体为原子晶体,只存在共价键,每个P与4个Ga以单键相连,每个Ga也与4个P以单键相连,而P最外层有5个电子、Ga最外层有3个电子,只能形成三对共用电子对,它们之间有四个共价键,所以有一个配位键,P与Ga之间存在的单键是极性共价键,是σ键,故答案为:BCE;
③二者都是原子晶体,砷的原子半径大于磷,磷化镓中键长小于砷化镓中的键长,熔点较高的是GaP,故答案为:GaP;二者均为共价晶体,P原子半径小于As,P-Ga键长小于As-Ga键长,GaP键能更大,熔点更高;
④P原子1和P原子2及其对称的另外两个P原子为正四面体结构,根据投影图可知晶胞在三维坐标的位置如图 ,则原子2的分数坐标为(0.25,0.25,0.25);晶胞中P原子数为4,Ga原子数为8×
,则原子2的分数坐标为(0.25,0.25,0.25);晶胞中P原子数为4,Ga原子数为8×![]() +6×
+6×![]() =4,化学式为GaP,晶胞的质量m=
=4,化学式为GaP,晶胞的质量m=![]() g=
g=![]() g,晶胞的体积V=
g,晶胞的体积V=![]() =
=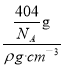 =
=![]() cm3,晶胞的边长a=
cm3,晶胞的边长a=![]() cm,P原子与周围最近的4个Ga原子形成正四面体,晶胞顶点Ga原子与四面体中心P原子连线处于晶胞体对角线上,且二者距离等于体对角线长度的
cm,P原子与周围最近的4个Ga原子形成正四面体,晶胞顶点Ga原子与四面体中心P原子连线处于晶胞体对角线上,且二者距离等于体对角线长度的![]() ,而体对角线长度等于晶胞棱长的
,而体对角线长度等于晶胞棱长的![]() 倍,所以晶胞中Ga和P原子的最近距离为
倍,所以晶胞中Ga和P原子的最近距离为![]() a=
a=![]() ×
×![]() cm=
cm=![]() ×
×![]() ×1010pm,故答案为:(0.25,0.25,0.25);
×1010pm,故答案为:(0.25,0.25,0.25);![]() ×
×![]() ×1010。
×1010。

【题目】下列选项中的原因或结论与现象不对应的是
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
C | 在密闭容器中有反应:A+xB(g) | A为非气体、x=1 |
D | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL 0.015mol·L-1 KSCN溶液,溶液呈红色,再滴加几滴1mol·L-1 KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
A. A B. B C. C D. D
【题目】乙醛在氧化铜催化剂存在的条件下,可以被空气氧化成乙酸。依据此原理设计实验制得并在试管C中收集到少量乙酸溶液(如图所示:试管A中装有40%的乙醛水溶液、氧化铜粉末;试管C中装有适量蒸馏水;烧杯B中装有某液体)。已知在60℃~80℃时用双连打气球鼓入空气即可发生乙醛的氧化反应,连续鼓入十几次反应基本完全。有关物质的沸点见下表
物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
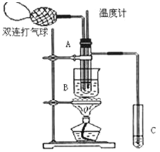
请回答下列问题:
(1)试管A内在60~80℃时发生的主要反应的化学方程式为(注明反应条件)________________________;
(2)如图所示在实验的不同阶段,需要调整温度计在试管A内的位置,在实验开始时温度计水银球的位置应在________________________________,目的是________________________;当试管A内的主要反应完成后温度计水银球的位置应在________________,目的是________。
(3)烧杯B的作用是________;烧杯B内盛装的液体可以是________(写出一种即可,在题给物质中找)
(4)写出乙酸和碳酸氢钠反应的离子方程式________________________。
【题目】1,2-二氯丙烷(CH2C1CHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2C1),反应原理为:
I.CH2=CHCH3(g)+C12(g)![]() CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
II.CH2=CHCH3(g)+C12(g)![]() CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2C1(g)+HC1(g)![]() CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
(2)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和C12(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
②该温度下,若平衡时HC1的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() _______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
_______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
(3)某研究小组向密闭容器中充入一定量的CH2=CHCH3和C12,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2C1CHC1CH3的产率与温度的关系如下图所示。
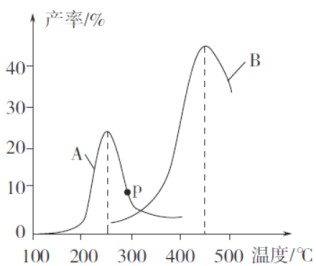
①下列说法错误的是___________(填代号)。
a.使用催化剂A的最佳温度约为250℃
b.相同条件下,改变压强不影响CH2C1CHC1CH3的产率
c.两种催化剂均能降低反应的活化能,但△H不变
d.提高CH2C1CHC1CH3反应选择性的关键因素是控制温度
②在催化剂A作用下,温度低于200℃时,CH2C1CHC1CH3的产率随温度升高变化不大,主要原因是_______________________________________________________________。
③p点是否为对应温度下CH2C1CHC1CH3的平衡产率,判断理由是_____________。