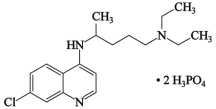
题目内容
【题目】用氯气生产某些含氯有机物时会产生副产物氯化氢。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:①反应A中,4 mol氯化氢被氧化,放出115.6 kJ的热量。
②
(1)断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差约为________kJ,
(2)水分子中H—O键比氯化氢分子中H—Cl键(填“强”或“弱”)________。
【答案】32 强
【解析】
根据图示键能的大小及反应中成键断键情况和反应中能量变化分析计算键能的大小。
(1)在反应A中,若断开4 mol H-Cl键,则同时断开1 mol O=O键,形成2 mol Cl-Cl键和4 mol H-O键,此时反应放出的能量为115.6 kJ,由图可知,断开1 mol O=O键吸收的能量为1 mol×498 kJ·mol-1=498 kJ,形成2 mol Cl-Cl键放出的能量为2 mol×243 kJ·mol-1=486 kJ,二者的能量差为498 kJ-486 kJ=12kJ,则断开4 mol H-Cl键与形成4 mol H-O键的能量差为115.6 kJ+12 kJ=127.6 kJ,所以断开1 mol H-O键与断键1 mol H-Cl键所需的能量差约为![]() ,故答案为:32;
,故答案为:32;
(2)根据上述分析断开1 mol H-O键比断键1 mol H-Cl多消耗能量,所以水中H-O键比氯化氢中H-Cl键强,故答案为:强。

练习册系列答案
相关题目