题目内容
【题目】1,2-二氯丙烷(CH2C1CHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2C1),反应原理为:
I.CH2=CHCH3(g)+C12(g)![]() CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
II.CH2=CHCH3(g)+C12(g)![]() CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2C1(g)+HC1(g)![]() CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
(2)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和C12(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
②该温度下,若平衡时HC1的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() _______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
_______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
(3)某研究小组向密闭容器中充入一定量的CH2=CHCH3和C12,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2C1CHC1CH3的产率与温度的关系如下图所示。

①下列说法错误的是___________(填代号)。
a.使用催化剂A的最佳温度约为250℃
b.相同条件下,改变压强不影响CH2C1CHC1CH3的产率
c.两种催化剂均能降低反应的活化能,但△H不变
d.提高CH2C1CHC1CH3反应选择性的关键因素是控制温度
②在催化剂A作用下,温度低于200℃时,CH2C1CHC1CH3的产率随温度升高变化不大,主要原因是_______________________________________________________________。
③p点是否为对应温度下CH2C1CHC1CH3的平衡产率,判断理由是_____________。
【答案】164 0.09 74% 0.21 bd 温度较低,催化剂的活性较低,对化学反应速率的影响小 不是平衡产率,因为该反应的正反应为放热反应,降低温度平衡向正反应方向移动,p点的平衡产率应高于B催化剂作用下450℃的产率
【解析】
(1)已知:I.CH2=CHCH3(g)+C12(g)![]() CH2C1CHC1CH3(g) △H1=—134kJ·mol-1,II.CH2=CHCH3(g)+C12(g)
CH2C1CHC1CH3(g) △H1=—134kJ·mol-1,II.CH2=CHCH3(g)+C12(g)![]() CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1,根据盖斯定律可知,I-II得CH2=CHCH2C1(g)+HC1(g)
CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1,根据盖斯定律可知,I-II得CH2=CHCH2C1(g)+HC1(g)![]() CH2C1CHC1CH3(g),此反应的反应热△H=Ea(正)-Ea(逆);
CH2C1CHC1CH3(g),此反应的反应热△H=Ea(正)-Ea(逆);
(2)①因反应II的△V=0,△p=0,则反应I的△p=80kPa-69.4kPa=10.6kPa,根据![]() ,计算120min内平均反应速率v(CH2C1CHC1CH3);
,计算120min内平均反应速率v(CH2C1CHC1CH3);
②设起始时CH2=CHCH3(与)和C12(g)均为5mol,则容器内起始时总物质的量为10mol,根据恒温恒容条件下气体的物质的量与压强成正比可知,平衡时气体的总物质的量为10mol×![]() =7.2mol,减小的物质的量为10mol-7.2mol=2.8mol,根据反应I可知反应生成的CH2C1CHC1CH3(g)为2.8mol,平衡时HC1的体积分数为
=7.2mol,减小的物质的量为10mol-7.2mol=2.8mol,根据反应I可知反应生成的CH2C1CHC1CH3(g)为2.8mol,平衡时HC1的体积分数为![]() ,说明生成的HCl为7.2mol×
,说明生成的HCl为7.2mol×![]() =0.9mol,结合反应I、Ⅱ,则参加反应的丙烯的总物质的量为2.8mol+0.9mol=3.7mol,由此计算平衡时丙烯的平衡总转化率和反应I的平衡常数;
=0.9mol,结合反应I、Ⅱ,则参加反应的丙烯的总物质的量为2.8mol+0.9mol=3.7mol,由此计算平衡时丙烯的平衡总转化率和反应I的平衡常数;
(3)①a.由图示可知使用催化剂A时产率最高时温度约为250℃;
b.根据反应I的特点分析压强对产率的影响;
c.使用催化剂能改变反应的活化能,但不改变反应热;
d.不同催化剂对产率影响与温度有关;
②在催化剂A作用下,温度低于200℃时,CH2C1CHC1CH3的产率随温度升高变化不大,说明此时催化效率低;
③在相同温度下,不同的催化剂能改变反应速率,但不影响平衡状态,反应I是放热反应,温度升高平衡会逆向移动。
(1)已知:I.CH2=CHCH3(g)+C12(g)![]() CH2C1CHC1CH3(g) △H1=—134kJ·mol-1,II.CH2=CHCH3(g)+C12(g)
CH2C1CHC1CH3(g) △H1=—134kJ·mol-1,II.CH2=CHCH3(g)+C12(g)![]() CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1,根据盖斯定律可知,I-II得CH2=CHCH2C1(g)+HC1(g)
CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1,根据盖斯定律可知,I-II得CH2=CHCH2C1(g)+HC1(g)![]() CH2C1CHC1CH3(g),此反应的反应热△H=△H1-△H2=Ea(正)-Ea(逆),则Ea(逆)=Ea(正)-(△H1-△H2)=132kJ·mol-1-(—134kJ·mol-1+102kJ·mol-1)=164kJ·mol-1;
CH2C1CHC1CH3(g),此反应的反应热△H=△H1-△H2=Ea(正)-Ea(逆),则Ea(逆)=Ea(正)-(△H1-△H2)=132kJ·mol-1-(—134kJ·mol-1+102kJ·mol-1)=164kJ·mol-1;
(2) ①因反应II的△V=0,△p=0,则反应I的△p=80kPa-69.4kPa=10.6kPa,则120min内平均反应速率v(CH2C1CHC1CH3)=![]() =
=![]() kPa·min-1≈0.09kPa·min-1;
kPa·min-1≈0.09kPa·min-1;
②设起始时CH2=CHCH3(g)和C12(g)均为5mol,则容器内起始时总物质的量为10mol,根据恒温恒容条件下气体的物质的量与压强成正比可知,平衡时气体的总物质的量为10mol×![]() =7.2mol,减小的物质的量为10mol-7.2mol=2.8mol,根据反应I可知反应生成的CH2C1CHC1CH3(g)为2.8mol,平衡时HC1的体积分数为
=7.2mol,减小的物质的量为10mol-7.2mol=2.8mol,根据反应I可知反应生成的CH2C1CHC1CH3(g)为2.8mol,平衡时HC1的体积分数为![]() ,说明生成的HCl为7.2mol×
,说明生成的HCl为7.2mol×![]() =0.9mol,结合反应I、Ⅱ,则参加反应的丙烯的总物质的量为2.8mol+0.9mol=3.7mol,故平衡时丙烯的平衡总转化率α=
=0.9mol,结合反应I、Ⅱ,则参加反应的丙烯的总物质的量为2.8mol+0.9mol=3.7mol,故平衡时丙烯的平衡总转化率α=![]() ×100%=74%;另外平衡时CH2=CHCH3(g)和C12(g)均为1.3mol,CH2C1CHC1CH3为2.8mol,则反应I的平衡常数Kp=
×100%=74%;另外平衡时CH2=CHCH3(g)和C12(g)均为1.3mol,CH2C1CHC1CH3为2.8mol,则反应I的平衡常数Kp=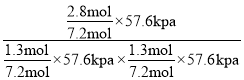 ≈0.21 kPa-1;
≈0.21 kPa-1;
(3)①a.由图示可知使用催化剂A时产率最高时温度约为250℃,即使用催化剂A的最佳温度约为250℃,故a正确;b.反应I是一个气体分子数减少的反应,改变压强可以使该反应的化学平衡发生移动,故CH2C1CHC1CH3的产率会随着压强的改变而改变,b错误;c.催化剂能降低反应的活化能,但不影响△H,故c正确;d.由图中信息可知,两种不同的催化剂对CH2C1CHC1CH3的产率的影响有明显的差别,催化剂明适宜的活化温度,故提高该反应的选择性的关键因素是催化剂的选择及其活化温度的控制,故d错误;故答案为bd;
②催化剂的效率与温度有关,当温度较低时,催化剂的活性较低,对化学反应速率的影响小,导致CH2C1CHC1CH3的产率随温度升高变化不大;
③反应I的正反应为放热反应,降低温度平衡向正反应方向移动,p点的平衡产率应高于B催化剂作用下450℃的产率,故p点不是对应温度下CH2C1CHC1CH3的平衡产率。

【题目】已知:一元弱酸HA的电离平衡常数K = 。25℃时,CH3COOH、HCN、H2CO3的电离平衡常数如下:
。25℃时,CH3COOH、HCN、H2CO3的电离平衡常数如下:
化学式 | CH3COOH | HCN | H2CO3 |
K | 1.75×10–5 | 4.9×10–10 | K1 = 4.4×10–7 K2 = 5.6×10–11 |
下列说法正确的是
A. 稀释CH3COOH溶液的过程中,n(CH3COO–)逐渐减小
B. NaHCO3溶液中:c(H2CO3) < c(![]() ) < c(HCO3)
) < c(HCO3)
C. 25℃时,相同物质的量浓度的NaCN溶液的碱性强于CH3COONa溶液
D. 向CH3COOH溶液或HCN溶液中加入Na2CO3溶液,均产生CO2