题目内容
4.(1)具有相等原子数的NH3和CH4两种气体,其分子数之比为5:4,在同温同压下两种气体的密度之比为17:16,此时的体积之比为5:4,此时的质量之比为85:84,质子数之比为5:4.(2)将20gNaOH固体溶于水配成100ml溶液,其密度为1.25g/mL.
①该溶液中NaOH的物质的量浓度为5mol/L;
②该溶液中NaOH的质量分数为16%;
③将取出的10mL溶液加水稀释,稀释后溶液中NaOH的物质的量浓度为1mol/L,加水稀释后溶液体积为50 mL.
分析 (1)根据n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$=$\frac{N}{{N}_{A}}$以及ρ=$\frac{m}{V}$=$\frac{M}{{V}_{m}}$结合分子、原子构成计算;
(2)n(NaOH)=$\frac{20g}{40g/mol}$=0.5mol,
①根据c=$\frac{n}{V}$计算;
②根据密度计算溶液的质量,进而可计算质量分数;
③根据溶液稀释前后溶质的物质的量不变计算.
解答 解:(1)具有相等原子数的NH3和CH4两种气体,分子数之比为5:4,体积之比为5:4,由ρ=$\frac{m}{V}$=$\frac{M}{{V}_{m}}$可知,在同温同压下两种气体的密度之比为17:16,
质量之比为5×17:4×16=85:84,
质子数之比为5×10:4×10=5:4,
故答案为:5:4;17:16;5:4;85:84;5:4.
(2)n(NaOH)=$\frac{20g}{40g/mol}$=0.5mol,
①c=$\frac{n}{V}$=$\frac{0.5mol}{0.1L}$=5mol/L,故答案为:5mol/L;
②溶液的质量为100mL×1.25g/mL=125g,则ω=$\frac{20g}{125g}×100%$=16%,故答案为:16%;
③将取出的10mL溶液加水稀释,稀释后溶液中NaOH的物质的量浓度为1mol/L,设加水稀释后溶液体积为VmL,则有0.01L×5mol/L=V×10-3L×1mol/L,V=50,
故答案为:50.
点评 本题综合考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意相关计算公式的运用,难度不大.

练习册系列答案
相关题目
14.下列表达反应的化学用语正确的是( )
| A. | 苯酚与纯碱溶液混合反应的离子方程式:2C6H5OH+CO32-→CO2↑+H2O+2C6H5O- | |
| B. | 溴乙烷发生水解反应的离子方程式:CH3CH2Br+OH-$→_{△}^{H_{2}O}$CH3CH2O-+H++Br- | |
| C. | 丙烯与水发生加成反应的化学方程式:CH2=CH-CH3+H2O$→_{△}^{催化剂}$CH3-O-CH2-CH3 | |
| D. | 苯酚稀溶液中加入饱和溴水: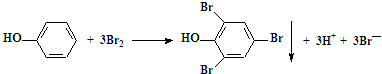 |
15.下列各式中属于盐的水解离子方程式的是( )
| A. | HCO3-+H2O?H3O++CO32- | B. | HCO3-+H2O?H2CO3+OH- | ||
| C. | HCO3-+H3O+═CO2+2H2O | D. | CO32-+H2O+CO2═2HCO3- |
19.标准状况下有以下四种气体:①6.72L CH4 ②3.01×1023 个HCl分子 ③13.6g H2S④0.2mol NH3.下列对四种气体的关系从小到大表示不正确的是( )
| A. | 物质的量:④<①<②<③ | B. | 体积:④<①<③<② | ||
| C. | 质量:④<①<③<② | D. | 氢原子个数:②<④<③<① |
9.已知某金属硝酸盐,在受热分解时生成了金属氧化物、二氧化氮与氧气.测得产物中NO2与O2的体积比为5:1(同温同压下测得),试分析该硝酸盐分解时金属化合价的变化情况是( )
| A. | 升高 | B. | 降低 | C. | 不变 | D. | 不能确定 |
16.下列分类标准正确的是( )
| A. | 化学反应分为:离子反应、非离子反应(标准:是否在水溶液中进行) | |
| B. | 分散系分为:溶液、胶体、浊液(标准:能否透过滤纸) | |
| C. | 化学反应分为:氧化还原反应、非氧化还原反应(标准:元素化合价是否发生变化) | |
| D. | 化合物分为:电解质、非电解质(标准:溶于水或熔融状态能否导电) |
17.下列营养物质中,不属于高分子化合物的是( )
| A. | 淀粉 | B. | 酶 | C. | 油脂 | D. | 天然橡胶 |