题目内容
15.下列各式中属于盐的水解离子方程式的是( )| A. | HCO3-+H2O?H3O++CO32- | B. | HCO3-+H2O?H2CO3+OH- | ||
| C. | HCO3-+H3O+═CO2+2H2O | D. | CO32-+H2O+CO2═2HCO3- |
分析 A.该反应为碳酸氢根离子的电离的离子方程式;
B.碳酸氢根离子水解生成碳酸和氢氧根离子,属于水解反应;
C.该反应为碳酸氢根离子与氢离子反应生成二氧化碳气体和水,不属于水解反应;
D.该反应为碳酸根离子与二氧化碳、水反应生成碳酸氢根离子,不属于水解反应.
解答 解:A.反应HCO3-+H2O?H3O++CO32-为碳酸氢根离子的电离的离子方程式,不属于水解反应,故A错误;
B.HCO3-+H2O?H2CO3+OH-为碳酸氢根离子水解的离子方程式,故B正确;
C.HCO3-+H3O+═CO2↑+2H2O为碳酸氢根离子与酸反应生成二氧化碳气体和水,该反应为强酸制取弱酸,不属于水解反应,故C错误;
D.CO32-+H2O+CO2═2HCO3-为碳酸氢根离子与二氧化碳反应生成碳酸氢根离子,不属于水解反应,故D错误;
故选B.
点评 本题考查了离子方程式的判断,侧重考查反应类型的判断,题目难度中等,注意明确盐的水解反应与电解质的电离的区别,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
5.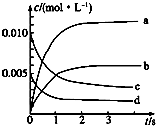 在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
(1)如图表示NO2的浓度变化的曲线是b.用O2表示从0~2s内该反应的平衡速率v=1.5×10-3mol•L-1•s-1.
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
 在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:
在2L密闭容器内,800℃时反应2NO(g)+O2(g)═2NO2(g)体系中,n(NO)随时间的变化如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)能说明该反应已达到平衡状态的是bc.
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变.
6.某化学小组准备用环己醇制备环己烯,查得相关资料如下.反应原理: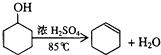
反应物与产物的物理性质:
(1)实验过程中可能发生的有机副反应的方程式为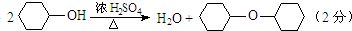 .
.
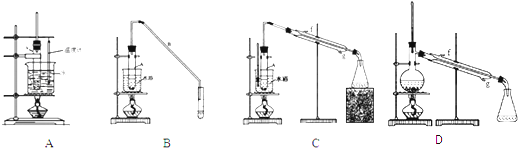
(2)根据上述资料,装置(A,B,C)C最适宜用来完成本次制备实验.
(3)制备粗产品
将5mL环己醇加入试管A中,再加入l0mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全.
(4)粗产品提纯
①环己烯粗产品中含有环己醇和少量酸性杂质等.粗产品需依次经过水洗、加碳酸钠溶液洗涤以及第二次水洗.在此过程中加入碳酸钠溶液的目的是除去环己烯中少量酸性杂质;分液时,环己烯应从分液漏斗的上(填“上”或“下”)口取出.
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入图D所示装置的蒸馏烧瓶(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为85℃.

反应物与产物的物理性质:
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
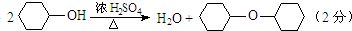 .
.(2)根据上述资料,装置(A,B,C)C最适宜用来完成本次制备实验.

(3)制备粗产品
将5mL环己醇加入试管A中,再加入l0mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全.
(4)粗产品提纯
①环己烯粗产品中含有环己醇和少量酸性杂质等.粗产品需依次经过水洗、加碳酸钠溶液洗涤以及第二次水洗.在此过程中加入碳酸钠溶液的目的是除去环己烯中少量酸性杂质;分液时,环己烯应从分液漏斗的上(填“上”或“下”)口取出.
②向水洗后的环己烯中加入少量的无水氯化钙,再将混合物放入图D所示装置的蒸馏烧瓶(填仪器名称)中,进行蒸馏,收集产品时,温度计显示的温度应为85℃.
3.下列说法中正确的是( )
| A. | 依据丁达尔现象可将分散系划分为溶液、胶体与浊液 | |
| B. | PM2.5(微粒直径约为2.5×10-6 m)分散在空气中形成气溶胶 | |
| C. | 光导纤维、聚乙烯、油脂都是高分子化合物 | |
| D. | 大雾的形成与汽车的尾气排放有很大关系 |
10.根据能量变化示意图,确定下列选项中正确的是( )
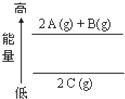

| A. | 2A(g)+B(g)=2 C(g)△H<0 | B. | 2A(g)+B(g)=2 C(g)△H>0 | C. | 2C(g)=2A(g)+B(g)△H>0 | D. | 2C(g)=2 A(g)+B(g)△H<0 |
20.下列有关化学实验的叙述正确的是( )
| A. | 用待测液润洗滴定用的锥形瓶 | |
| B. | 常温下,某同学用pH试纸测得KCl溶液的pH约为7.0 | |
| C. | 配制Fe2(SO4)3溶液时,先把Fe2(SO4)3晶体溶于浓硫酸后稀释 | |
| D. | 用碱式滴定管准确移取KMnO4溶液,体积为21.50mL |
7.下列离子方程式中正确的是( )
| A. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| B. | NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 稀硝酸和过量的铁屑反应:3 Fe+8H++2 NO3-=3 Fe3++2 NO↑+4 H2O | |
| D. | 大理石溶于醋酸的反应:CaCO3+CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
5.在同温同压下,两个容积相同的储气瓶,一个装满O2,另一个装满CH4,以下有关两瓶气体的计算不正确的是( )
| A. | O2与CH4质量比为 2:1 | B. | O2与CH4原子数之比为 1:1 | ||
| C. | O2与CH4密度比为2:1 | D. | O2与CH4分子数之比为1:1 |