题目内容
13.H2SO4的摩尔质量为98g/mol;1.204×1024个H2SO4含4.816×1024个氧原子,共含14mol原子,能和4molNaOH完全反应,该硫酸所含氢元素的质量与标准状况下89.6L HCl中所含氢元素的质量相同.分析 根据m=nM计算1.204×1024个H2SO4的物质的量,根据N=nNA计算硫酸分子数目,由化学式H2SO4可知n(O)=4n(H2SO4),所含氢元素的质量相同,故n(HCl)=n(H),再根据V=nVm计算体积.
解答 解:H2SO4的摩尔质量为98g/mol,由化学式H2SO4可知n(O)=4n(H2SO4),
则1.204×1024个H2SO4含4.816×1024个氧原子,
n(H2SO4)=$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}/mol}$=2mol,
则共含14mol原子,
能与4molNaOH反应,
由化学式H2SO4可知n(H)=2n(H2SO4)=2×2mol=4mol,所含氢元素的质量相同,故n(HCl)=n(H)=4mol,
所以氯化氢的体积为4mol×22.4L/mol=89.6L,
故答案为:98g/mol;4.816×1024;14;4;89.6.
点评 本题考查常用化学计量的有关计算,为高频考点,侧重于学生的分析、计算能力的考查,比较基础,注意公式的理解与灵活运用.

练习册系列答案
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
3.下列说法中正确的是( )
| A. | 依据丁达尔现象可将分散系划分为溶液、胶体与浊液 | |
| B. | PM2.5(微粒直径约为2.5×10-6 m)分散在空气中形成气溶胶 | |
| C. | 光导纤维、聚乙烯、油脂都是高分子化合物 | |
| D. | 大雾的形成与汽车的尾气排放有很大关系 |
1.下列描述中正确的是( )
| A. | CS2为V形的极性分子 | |
| B. | ClO3- 的空间构型为平面三角形 | |
| C. | SF6中S原子和氟原子均满足最外层8电子稳定结构 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化,SiF4分子呈空间正四面体,SO32-呈三角锥形 |
8.下列说法正确的是(NA表示阿伏加德罗常数)( )
| A. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| B. | 在常温常压下,11.2升氯气含有的分子数为0.5NA | |
| C. | 在常温常压下,1摩尔气体含有的原子数为NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含原子数目相同 |
18.CuSO4•5H2O是配合物,显蓝色,其溶液加入NH3后变深蓝,加入乙醇后有晶体析出,则下列说法不正确的是( )
| A. | H2O作配体时,Cu与H2O形成σ键 | B. | H2O的配位能力大于NH3 | ||
| C. | 乙醇可减小离子晶体的溶解度 | D. | Cu(NH3)4SO4遇BaCl2有白色沉淀生成 |
5.在同温同压下,两个容积相同的储气瓶,一个装满O2,另一个装满CH4,以下有关两瓶气体的计算不正确的是( )
| A. | O2与CH4质量比为 2:1 | B. | O2与CH4原子数之比为 1:1 | ||
| C. | O2与CH4密度比为2:1 | D. | O2与CH4分子数之比为1:1 |
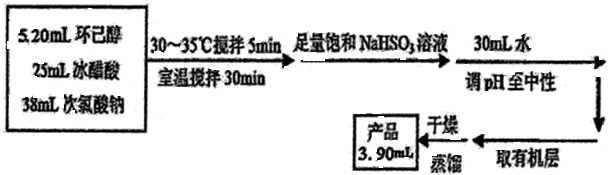
5.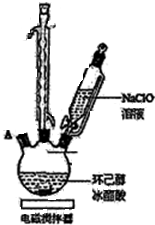 环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
有关物质信息、实验流程及实验装置如图:
实验使用的NaClO溶液的浓度是1.8mol/L
(1)实验中盛装NaClO溶液的仪器比普通分液漏斗多了一个侧管,此设计的目的为平衡气压,使液体可以顺利流下.
(2)次氯酸钠氧化环己醇的反应放出大量的热,为了将体系温度维持在30~35℃,除了用冰水水浴冷却外,采取的措施还可能有缓慢滴加NaClO溶液或电磁搅拌器搅拌等,并应在三颈瓶的A端口处应补加温度计(仪器名称).
(3)实验过程中NaClO溶液氧化环己醇的化学方程式为 .
.
(4)为将溶液的pH调至中性,可以加入的试剂是碳酸钠或氢氧化钠等.
(5)在实验过程中,获得产品的蒸馏操作中不可使用水冷凝管,而应使用空气冷凝管( ),其最可能的原因是A(填写选项编号)
),其最可能的原因是A(填写选项编号)
A、防止因温差过大,水冷凝管易炸裂
B、空气冷凝管结构简单,易于安装
C、空气冷凝管冷凝效果更佳
(6)计算本实验过程中环己酮的产率75.7%.
 环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
有关物质信息、实验流程及实验装置如图:
| 密度g/cm3 | 沸点℃ | 熔点℃ | 水溶性 | |
| 乙酸 | 1.05 | 117.9 | 16.6 | 易溶 |
| 环己醇 | 0.96 | 160.8 | 25.9 | 微溶 |
| 环己酮 | 0.95 | 155 | -4.5 | 能溶 |

(1)实验中盛装NaClO溶液的仪器比普通分液漏斗多了一个侧管,此设计的目的为平衡气压,使液体可以顺利流下.
(2)次氯酸钠氧化环己醇的反应放出大量的热,为了将体系温度维持在30~35℃,除了用冰水水浴冷却外,采取的措施还可能有缓慢滴加NaClO溶液或电磁搅拌器搅拌等,并应在三颈瓶的A端口处应补加温度计(仪器名称).
(3)实验过程中NaClO溶液氧化环己醇的化学方程式为
 .
.(4)为将溶液的pH调至中性,可以加入的试剂是碳酸钠或氢氧化钠等.
(5)在实验过程中,获得产品的蒸馏操作中不可使用水冷凝管,而应使用空气冷凝管(
 ),其最可能的原因是A(填写选项编号)
),其最可能的原因是A(填写选项编号)A、防止因温差过大,水冷凝管易炸裂
B、空气冷凝管结构简单,易于安装
C、空气冷凝管冷凝效果更佳
(6)计算本实验过程中环己酮的产率75.7%.
6.在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 1L0.1mol•L-1(NH4)2Fe(SO4)2•6H2O的溶液中:c(NH4+)+c(Fe2+)+c(H+)═c(OH-)+c (SO42-) | |
| B. | 0.1 mol•L-1 NH4HS溶液中:c(NH4+)<c(HS-)+c(H2S)+c(S2-) | |
| C. | 0.1mol•L-1pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-) | |
| D. | 等浓度的碳酸钠和碳酸氢钠溶液混合后的溶液中:c(OH-)+c(CO32-)═c(HCO3-)+c(H2CO3)+c(H+) |