题目内容
13.对于0.1mol•L-1 Na2CO3溶液,下列说法正确的是( )| A. | 升高温度,溶液的pH降低 | |
| B. | c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | c(Na+)+c(H+)=2 c(CO32-)+2c(HCO3-)+c(OH-) | |
| D. | 加入少量NaOH固体,c(CO32-)与c(Na+)均增大 |
分析 A、碳酸根离子水解溶液显碱性,碳酸根离子水解过程是吸热反应,升温平衡正向进行;
B、依据溶液中物料守恒分析判断,n(Na)=2n(c);
C、溶液中存在电荷守恒分析,阳离子和阴离子所带电荷数相同;
D、碳酸钠水解显碱性,加入氢氧化钠氢氧根离子浓度增大平衡逆向进行.
解答 解:A、碳酸根离子水解溶液显碱性,碳酸根离子水解过程是吸热反应,升温平衡正向进行,氢氧根离子浓度增大,溶液PH增大,故A错误;
B、依据溶液中物料守恒分析判断,n(Na)=2n(c),溶液中离子浓度存在c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故B错误;
C、溶液中存在电荷守恒分析,阳离子和阴离子所带电荷数相同,c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-),故C错误;
D、碳酸钠水解显碱性,加入氢氧化钠氢氧根离子浓度增大平衡逆向进行,溶液中碳酸根离子浓度增大,钠离子浓度增大,故D正确;
故选D.
点评 本题考查了电解质溶液中离子浓度大小比较,溶液中物料守恒、电荷守恒、离子浓度大小比较等,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
6.化学实验有助于理解化学知识,形成化学观念.下列实验操作正确的是( )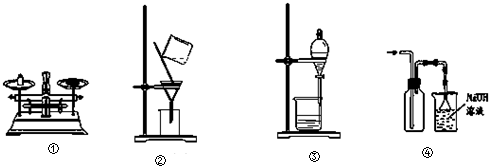

| A. | ①称量药品 | B. | ②过滤 | C. | ③分离乙醇和水 | D. | ④收集氯气 |
1.某恒温密闭容器中,可逆反应A(s)?B+C(g)△H=-a KJ/mol 达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )
| A. | 产物B的状态只能为固态或液态 | |
| B. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| C. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量a KJ | |
| D. | 衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 |
5.下列离子方程式,书写正确的是( )
| A. | 盐酸与碳酸钡反应 CO32-+2H+═CO2↑+H2O | |
| B. | 硫酸铜溶液中滴加氢氧化钡溶液 Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ | |
| C. | 硝酸银溶液中加入铜粉 Ag++Cu═Cu2++Ag↓ | |
| D. | 铁与稀盐酸反应 2Fe+6H+═2Fe3++3H2↑ |
2.下述实验操作与预期实验目的或所得实验结论不一致的是( )
| 编号 | 实验操作 | 实验目的或结论 |
| A | 将SO2气体通入紫色石蕊试液中,观察溶液是否褪色 | 证明SO2有漂白性 |
| B | 向试管中加入等体积的0.005mol/L的FeCl3溶液和0.01mol/L的KSCN溶液,再滴加几滴饱和FeCl3溶液,观察颜色变化 | 探究增大反应物浓度时平衡移动的方向 |
| C | 将装有NO2和N2O4气体的联通球,一个置于冰水中,一个置于热水中,观察颜色变化 | 探究温度对化学平衡的影响 |
| D | 将CO2通入Na2SiO3水溶液观察是否有沉淀产生 | 探究碳和硅两元素非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
3.在一定体积的密闭容器中,进行如下化学反应:
CO(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{\;}$CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
请回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{C(CO{\;}_{2})•C(H{\;}_{2})}{C(CO)•C(H{\;}_{2}O)}$,该反应为放热反应(填“吸热”或
“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是BC.
A.容器中压强不变
B.混合气体中c(CO)不变
C.v生成(H2)=v消耗(H2)
D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,缩小容器的体积,平衡不移动(填“向正反应方向”、“向逆反应方向”或“不”).
CO(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{\;}$CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
| t/(℃) | 700 | 80 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的化学平衡常数表达式为K=$\frac{C(CO{\;}_{2})•C(H{\;}_{2})}{C(CO)•C(H{\;}_{2}O)}$,该反应为放热反应(填“吸热”或
“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是BC.
A.容器中压强不变
B.混合气体中c(CO)不变
C.v生成(H2)=v消耗(H2)
D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,缩小容器的体积,平衡不移动(填“向正反应方向”、“向逆反应方向”或“不”).
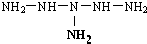 或NH2-NH-NH-NH-NH-NH2.
或NH2-NH-NH-NH-NH-NH2.