题目内容
3.在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)$\frac{\underline{\;催化剂\;}}{\;}$CO2(g)+H2(g),其化学平衡常数K和温度t的关系如表:
| t/(℃) | 700 | 80 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的化学平衡常数表达式为K=$\frac{C(CO{\;}_{2})•C(H{\;}_{2})}{C(CO)•C(H{\;}_{2}O)}$,该反应为放热反应(填“吸热”或
“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是BC.
A.容器中压强不变
B.混合气体中c(CO)不变
C.v生成(H2)=v消耗(H2)
D.c(CO2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,缩小容器的体积,平衡不移动(填“向正反应方向”、“向逆反应方向”或“不”).
分析 (1)依据化学方程式和平衡常数概念写出表达式,用生成物浓度的幂次方乘积除以反应物的幂次方乘积,依据平衡常数随温度升高减小说明平衡逆向进行,逆向是吸热反应正向为放热反应;
(2)依据化学平衡的标志是正逆反应速率相同,各组分浓度保持不变分析选项;
(3)依据反应是气体体积不变的反应,改变压强不影响化学平衡移动判断.
解答 解:(1)在一定体积的密闭容器中,进行如下化学反应:CO(g)+H2O(g)$\stackrel{催化剂}{?}$CO2(g)+H2(g),平衡常数K=$\frac{C(CO{\;}_{2})•C(H{\;}_{2})}{C(CO)•C(H{\;}_{2}O)}$,图表中平衡常数随温度升高减小说明平衡逆向进行,逆向是吸热反应正向为放热反应,
故答案为:$\frac{C(CO{\;}_{2})•C(H{\;}_{2})}{C(CO)•C(H{\;}_{2}O)}$;放热;
(2)A、反应是气体体积不变的反应,过程中和平衡状态容器中压强不变,不能说明反应达到平衡状态,故A不符合;
B、混合气体中c(CO)不变,是平衡标志,说明反应达到平衡,故B符合;
C、v生成(H2)=v消耗(H2)说明氢气的正逆反应速率相同,故C符合;
D、c(CO2)=c(CO),只能说明某一时刻可能相同,但不能说明浓度不变,故D不符合;
故答案为:BC;
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,缩小容器的体积,因为反应是气体体积不变的反应,改变压强不影响化学平衡移动,
故答案为:不.
点评 本题考查了化学平衡的计算应用,平衡标志的分析判断,平衡常数概念的分析理解是解题关键.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
13.对于0.1mol•L-1 Na2CO3溶液,下列说法正确的是( )
| A. | 升高温度,溶液的pH降低 | |
| B. | c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | c(Na+)+c(H+)=2 c(CO32-)+2c(HCO3-)+c(OH-) | |
| D. | 加入少量NaOH固体,c(CO32-)与c(Na+)均增大 |
14.下列物质不属于电解质的是( )
| A. | 金刚石 | B. | NaCl | C. | NaOH | D. | BaSO4 |
11.能够证明苯分子不存在碳碳单、双键交替排布的事实是( )
| A. | 苯的一溴代物没有同分异构体 | B. | 苯的间位二溴代物只有一种 | ||
| C. | 苯能在空气中燃烧 | D. | 苯的邻位二溴代物只有一种 |
18. 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )
 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,下列说法中正确的是( )| A. | 从反应开始到第一次平衡时,N2的平均反应速率为0.005 mol•L-1•min-1 | |
| B. | 平衡在10 min至20 min的变化,可能是因为增大了容器体积 | |
| C. | 25 min时,分离出了0.1 mol NH3 | |
| D. | 在25 min后平衡向正反应方向移动,新平衡中NH3的体积分数比原平衡的小 |
8.向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图1所示.图2为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.
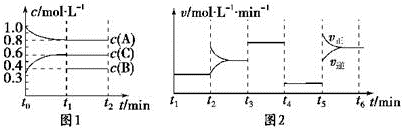
已知t3-t4阶段为使用催化剂;图1中t0-t1阶段c (B)未画出.
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=0.02mol•L-1•min-1.
(2)(2)t4-t5阶段改变的条件为减小压强,B的起始物质的量为1.0mol.各阶段平衡时对应的平衡常如表所示:
则K1=0.84(保留两位小数),K1、K2、K3、K4、K5之间的关系为K1=K2=K3=K4<K5(用“>”“<”或“=”连接).
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:2A(g)+B(g)?3C(g);△H=+200a kJ•mol-1.
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为a+$\frac{2}{3}$c=2.4且b+$\frac{1}{3}$c=1.2.

已知t3-t4阶段为使用催化剂;图1中t0-t1阶段c (B)未画出.
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)=0.02mol•L-1•min-1.
(2)(2)t4-t5阶段改变的条件为减小压强,B的起始物质的量为1.0mol.各阶段平衡时对应的平衡常如表所示:
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
(3)t5-t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:2A(g)+B(g)?3C(g);△H=+200a kJ•mol-1.
(4)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,达到平衡时体系中各物质的量与t1时刻相等,a、b、c要满足的条件为a+$\frac{2}{3}$c=2.4且b+$\frac{1}{3}$c=1.2.
13.二氧化碳气体中含有少量氯化氢杂质,若要除杂,最好选用( )
| A. | 饱和碳酸钠溶液 | B. | 浓硫酸 | ||
| C. | 饱和碳酸氢钠溶液 | D. | 饱和石灰水 |