题目内容
3. 前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与Ar原子相同;R原子的d轨道上有3个空轨道.请回答下列问题:
前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与Ar原子相同;R原子的d轨道上有3个空轨道.请回答下列问题:(1)R原子的基态电子排布式为[Ar]3d24s2.
(2)X、Y原子的第一电离能大小顺序为N>O.(用元素符号表示)
(3)X的常见单质分子结构中σ键数目为1.
(4)Z的最高价氧化物对应水化物的酸根离子空间构型为正四面体,中心原子的杂化轨道类型为sp3.
(5)下列分子即不存在s-pσ键,也不存在p-pπ键的是D.
A.HCl B.HF C.SO2 D.SCl2
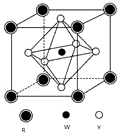
(6)某矿物晶体由Y、W、R三种元素组成,其晶胞结构如图所示.则该矿物的化学式为CaTiO3,若已知该晶胞的边长为acm,则该晶胞的密度为136a3NAg/cm3.(用含a、NA的代数式表示)
分析 前四周期元素X、Y、Z、W、R的原子序数依次增大,X原子的2p轨道为半充满状态,则X为N元素,Z与Y位于同主族,Y原子的L层有2个未成对电子,则Y为O元素,Z为S元素;W的+2价简单离子核外电子层排布与Ar原子相同,则W为Ca元素,R原子的d轨道上有3个空轨道,外围电子排布为3d24s2,则R为Ti.
(1)根据原子排布构造原理书写;
(2)同周期元素第一电离能自左向右逐渐增大,但是N原子的2P轨道半充满,属于稳定结构,第一电离能大于O原子的;
(3)氮气分子中N原子之间形成N≡N三键,三键含有1个σ键,2个π键;
(4)Z为S元素,最高价氧化物对应水化物的酸根离子为SO42-,计算S原子价层电子对数、孤电子对数,判断杂化方式和空间构型;
(5)HCl、HF分子中存在s-pσ键,SO2中含有双键,存在p-pπ键,SCl2中存在p-pσ键;
(6)利用均摊法计算化学式,根据密度公式计算密度.
解答 解:前四周期元素X、Y、Z、W、R的原子序数依次增大,X原子的2p轨道为半充满状态,则X为N元素,Z与Y位于同主族,Y原子的L层有2个未成对电子,则Y为O元素,Z为S元素;W的+2价简单离子核外电子层排布与Ar原子相同,则W为Ca元素,R原子的d轨道上有3个空轨道,外围电子排布为3d24s2,则R为Ti.
(1)R为Ti,原子的基态电子排布式为[Ar]3d24s2,故答案为:[Ar]3d24s2;
(2)X、Y分别为N和O,由于N原子2P轨道半充满,第一电离能大于O的,即原子的第一电离能大小顺序为N>O,故答案为:N>O;
(3)X为N元素,常见单质分子中N原子之间形成N≡N三键,三键含有1个σ键,2个π键,故答案为:1;
(4)Z为S元素,最高价氧化物对应水化物的酸根离子为SO42-,中心原子S电子对数为4+6+2−2×42=4,孤电子对数为0,SO42-的空间构型为正四面体,S原子杂化数目为4,其杂化类型为sp3,故答案为:正四面体;sp3;
(5)A. HCl中存在s-pσ键,故错误;
B.HF中存在s-pσ键,故错误;
C.SO2中含有双键,存在p-pπ键,故错误;
D. SCl2中S原子与Cl原子中形成单键,存在p-pσ键,故正确;
故选D;
(6)Y、W、R三种元素分别为O、Ca、Ti,O位于面心,O原子数目为6×12=3,Ca位于体心,Ca原子数目为1,Ti位于顶点,Ti原子数目为8×18=1,故化学式为CaTiO3,晶胞质量为40+48+16×3NAg,该晶胞的边长为a cm,则该晶胞的密度ρ=mV=40+48+16×3NAg÷(a cm)3=136a3NAg/cm3,故答案为:CaTiO3;136a3NA.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、杂化方式、空间构型、化学键、晶胞计算等,需要学生具备扎实的基础,难度中等.

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案| A. | 仅由非金属元素不可能形成离子化合物 | |
| B. | 构成分子的粒子一定含有共价键 | |
| C. | 离子化合物中可能含有共价键 | |
| D. | 凡是有化学键断裂过程一定发生了化学反应 |
| A. | H2SO4 | B. | (NH4)2SO4 | C. | NH3•H2O | D. | NH4HSO4 |
| A. | Cl-,Mg2+,K+,SO42- | B. | NH4+,Cl-,Na+,Ba2+ | ||
| C. | Fe2+,NO3-,Cl-,Na+ | D. | HCO3-,K+,NH4+,SO42- |
| A. | NaClO溶液 | B. | 双氧水 | C. | 苯酚 | D. | 75%的酒精 |
 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电反应的化学方程式为:2Na2S2+NaBr3?放电充电Na2S4+3NaBr,下列关于此电池说法正确的是( )
如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电反应的化学方程式为:2Na2S2+NaBr3?放电充电Na2S4+3NaBr,下列关于此电池说法正确的是( )| A. | 充电过程中,当0.1 mol Na+通过离子交换膜时,导线通过0.1 mol电子 | |
| B. | 电池放电时,负极反应为:3NaBr一2e-═NaBr3+2Na+ | |
| C. | 充电过程中钠离子从右到左通过离子交换膜 | |
| D. | 放电过程中钠离子从左到右通过离子交换膜 |
| A. | CH4 | B. | NH4+ | C. | Cl- | D. | OH- |
| A. | 观察焰色反应实验为黄色火焰,则可证明该溶液中含有Na+ | |
| B. | 金属单质导电与电解质溶液导电原因是一样的 | |
| C. | 常温下浓硫酸与铁不反应,故常温下可用铁制容器贮藏贮运浓硫酸 | |
| D. | 可用Na与MgCl2溶液反应制Mg |

