题目内容
13.下列有关金属及其化合物的知识说法正确的是( )| A. | 观察焰色反应实验为黄色火焰,则可证明该溶液中含有Na+ | |
| B. | 金属单质导电与电解质溶液导电原因是一样的 | |
| C. | 常温下浓硫酸与铁不反应,故常温下可用铁制容器贮藏贮运浓硫酸 | |
| D. | 可用Na与MgCl2溶液反应制Mg |
分析 A、钠元素焰色反应为黄色;
B、金属导电是自由电子定向移动,电解质溶液导电是溶液中离子发生氧化还原反应;
C、铁常温下在浓硫酸中发生钝化现象是发生了氧化还原反应;
D、钠和水溶液中的水反应生成氢氧化钠和氢气.
解答 解:A、钠元素焰色反应为黄色,观察焰色反应实验为黄色火焰,则可证明该溶液中含有Na+,故A正确;
B、金属导电是自由电子定向移动,电解质溶液导电是溶液中离子发生氧化还原反应,金属单质导电与电解质溶液导电原因不同,故B错误;
C、铁常温下在浓硫酸中发生钝化现象是发生了氧化还原反应,氧化膜阻止反应进行,故常温下可用铁制容器贮藏贮运浓硫酸,故C错误;
D、钠和水溶液中的水反应生成氢氧化钠和氢气,氢氧化钠和氯化镁反应生成氢氧化镁沉淀,不能置换镁,故D错误;
故选A.
点评 本题考查了物质性质的分析判断,主要是金属性质的理解应用,注意钝化现象是发生了氧化还原反应,题目较简单.

练习册系列答案
相关题目
4.物质的量浓度和体积均相同的下列溶液中,含阴离子种类最多的是( )
| A. | CaCl2 | B. | CH3COONa | C. | (NH4)2SO4 | D. | K2CO3 |
1.短周期元素Q、W、Y原子序数依次增大,原子结构及性质如表所示:
(1)Y在元素周期表中的位置是第三周期ⅢA族.
(2)短周期中与W同主族元素的最高价氧化物的化学式SO3.
(3)元素Q的氧化物(溫室气体)、氢化物属于共价化合物(填“离子”、或“共价”),这些化合物分子内微粒间存在的作用力属于共价键(填离子键或共价键).
(4)单质Y可以发生如图所示的变化,回答:
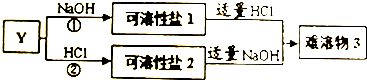
①写出反应①的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
②下列化合物可替代Y发生如图所示的变化的是AC(填选项).
A、Y2O3 B、Y2(SO4)3 C、Y(OH)3 D、Y(NO3)3
③写出难溶物3的化学式Al(OH)3.
| 元素 | 结构与性质 |
| Q | Q元素的最高正、负价代数和为0.最高价氧化物为温室气体之一• |
| W | W是地壳中含量最高的非金属元素. |
| Y | Y所处的周期序数与主族序数相等,为地壳中含量最高的金属元素. |
(2)短周期中与W同主族元素的最高价氧化物的化学式SO3.
(3)元素Q的氧化物(溫室气体)、氢化物属于共价化合物(填“离子”、或“共价”),这些化合物分子内微粒间存在的作用力属于共价键(填离子键或共价键).
(4)单质Y可以发生如图所示的变化,回答:

①写出反应①的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
②下列化合物可替代Y发生如图所示的变化的是AC(填选项).
A、Y2O3 B、Y2(SO4)3 C、Y(OH)3 D、Y(NO3)3
③写出难溶物3的化学式Al(OH)3.
18.把7.4g Na2CO3•10H2O和NaHCO3组成的混合物溶于水配成100mL溶液,测得溶液中钠离浓度为0.6mol/L.若把等质量的混合物加热至恒重,残留物的质量是( )
| A. | 3.18 g | B. | 2.12 g | C. | 4.22 g | D. | 5.28 g |
5.探究氯气是否具有漂白性实验如图:若关闭Ⅰ阀,打开Ⅱ阀,让一定量潮湿的氯气经过甲瓶后,进入乙瓶,乙瓶中布条不褪色.则甲瓶中所盛的试剂可能是:( )
①Na2SO3溶液 ②NaOH溶液 ③浓H2SO4 ④饱和NaCl溶液 ⑤KBr溶液.
①Na2SO3溶液 ②NaOH溶液 ③浓H2SO4 ④饱和NaCl溶液 ⑤KBr溶液.

| A. | ②④ | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②④ |
2.与纯水的电离相似,液氨中也存在着微弱的电离:2NH3?NH4++NH2-,据此判断以下叙述中不正确的是( )
| A. | 液氨中含有NH3、NH4+、NH2-微粒 | |
| B. | 其他条件不变,若增加液氨的量,电离平衡将正向移动 | |
| C. | 只要不加入其他物质,液氨中c(NH4+)=c(NH2-) | |
| D. | 一定温度下液氨中c(NH4+)•c(NH2-)是一个常数 |
3.下列有关反应的颜色变化不正确的是( )
| A. | 氯水久置后黄绿色消失 | |
| B. | 淀粉溶液遇碘单质变蓝 | |
| C. | SO2使品红溶液褪色 | |
| D. | 溴水中加入CCl4溶液,振荡静置后,上层呈橙红色 |
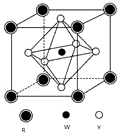 前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与Ar原子相同;R原子的d轨道上有3个空轨道.请回答下列问题:
前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与Ar原子相同;R原子的d轨道上有3个空轨道.请回答下列问题: