题目内容
15.某无色溶液与铝反应放出氢气,该溶液肯定不能大量共存的离子组是( )| A. | Cl-,Mg2+,K+,SO42- | B. | NH4+,Cl-,Na+,Ba2+ | ||
| C. | Fe2+,NO3-,Cl-,Na+ | D. | HCO3-,K+,NH4+,SO42- |
分析 无色溶液时可排除Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,与铝反应生成氢气的溶液为酸性或强碱性溶液,
A.酸性溶液中,四种离子之间不反应,能够共存;
B.酸性溶液中,四种离子之间不发生反应,能够共存;
C.亚铁离子为有色离子,不满足溶液无色的条件,且酸性条件下硝酸根离子具有强氧化性,与铝反应不会生成氢气,碱性溶液中亚铁离子与氢氧根离子反应;
D.碳酸氢根离子能够与氢离子和氢氧根离子反应.
解答 解:溶液无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,与铝反应生成氢气的溶液中存在大量氢离子或氢氧根离子,
A.Cl-,Mg2+,K+,SO42-之间不反应,若为酸性溶液,四种离子都不与氢离子反应,在溶液中可以大量共存,故A错误;
B.NH4+,Cl-,Na+,Ba2+之间不反应,都不与氢离子反应,在酸性溶液中能够大量共存,故B错误;
C.Fe2+为有色离子,且Fe2+与氢氧根离子反应,NO3-在酸性条件下具有氧化性,与铝反应不会生成氢气,在溶液中一定不能大量共存,故C正确;
D.HCO3-与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故D错误;
故选CD.
点评 本题考查离子共存的正误判断,为中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
5.以下比较中,正确的是( )
| A. | 微粒半径:O2-<F-<Na+<Li+ | |
| B. | 晶格能由大到小:NaI>NaBr>NaCl>NaF | |
| C. | 分子中的键角:CH4>H2O>CO2 | |
| D. | 共价键的键能:C-C>C-Si>Si-Si |
6.下列实验中,对应的现象以及结论都对应正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A. | 将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液 | 有气体生成,溶液呈血红色 | 稀硝酸将Fe氧化为Fe3+ |
| B. | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| C. | AgI沉淀中滴加稀KCl溶液 | 有白色沉淀出现 | AgCl的溶度积比AgI的小 |
| D. | 去少量无色溶液,先滴加氯水,再加入少量CCl4,振荡,静置 | 溶液分层,下层呈橙红色 | 原无色溶液中含有溴离子 |
| A. | A | B. | B | C. | C | D. | D |
20.下列化学式只代表一种纯净物分子的是( )
| A. | C(金刚石) | B. | NaCl | C. | C2H6O | D. | CH4 |
1.短周期元素Q、W、Y原子序数依次增大,原子结构及性质如表所示:
(1)Y在元素周期表中的位置是第三周期ⅢA族.
(2)短周期中与W同主族元素的最高价氧化物的化学式SO3.
(3)元素Q的氧化物(溫室气体)、氢化物属于共价化合物(填“离子”、或“共价”),这些化合物分子内微粒间存在的作用力属于共价键(填离子键或共价键).
(4)单质Y可以发生如图所示的变化,回答:
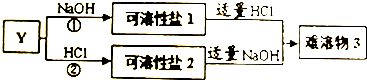
①写出反应①的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
②下列化合物可替代Y发生如图所示的变化的是AC(填选项).
A、Y2O3 B、Y2(SO4)3 C、Y(OH)3 D、Y(NO3)3
③写出难溶物3的化学式Al(OH)3.
| 元素 | 结构与性质 |
| Q | Q元素的最高正、负价代数和为0.最高价氧化物为温室气体之一• |
| W | W是地壳中含量最高的非金属元素. |
| Y | Y所处的周期序数与主族序数相等,为地壳中含量最高的金属元素. |
(2)短周期中与W同主族元素的最高价氧化物的化学式SO3.
(3)元素Q的氧化物(溫室气体)、氢化物属于共价化合物(填“离子”、或“共价”),这些化合物分子内微粒间存在的作用力属于共价键(填离子键或共价键).
(4)单质Y可以发生如图所示的变化,回答:

①写出反应①的离子方程式2Al+2H2O+2OH-=2AlO2-+3H2↑.
②下列化合物可替代Y发生如图所示的变化的是AC(填选项).
A、Y2O3 B、Y2(SO4)3 C、Y(OH)3 D、Y(NO3)3
③写出难溶物3的化学式Al(OH)3.
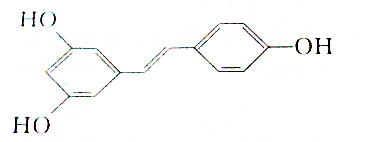 ,则白藜芦醇的分子式为C14H12O3.
,则白藜芦醇的分子式为C14H12O3.
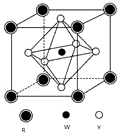 前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与Ar原子相同;R原子的d轨道上有3个空轨道.请回答下列问题:
前四周期元素X、Y、Z、W、R的原子序数依次增大,已知:X原子的2p轨道为半充满状态;Y原子的L层有2个未成对电子;Z与Y位于同主族;W的+2价简单离子核外电子层排布与Ar原子相同;R原子的d轨道上有3个空轨道.请回答下列问题: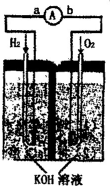 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定.请回答: