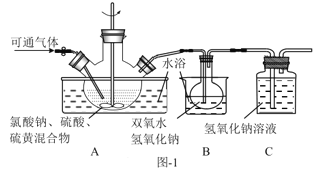
题目内容
【题目】为探究某矿物的主要成分X(仅含三种元素)的组成,某兴趣小组进行了如下实验:
①取55.2g固体X在空气存在下高温煅烧,有刺激性气味的气体产生(标况下为13.44L),该气体能使品红溶液褪色。
②高温煅烧后的固体用磁分离技术进行分离,得到19.2g红色固体单质和23.2g黑色固体。
③将23.2g固体溶于稀硫酸,再加氢氧化钠,将所得沉淀充分灼烧,得到24g红棕色固体。已知各步反应试剂均过量,请回答:
(1)X化学式为______
(2)写出X在空气存在下高温煅烧的化学反应方程式______
(3)写出X高温煅烧后的气体通入碘水中发生的离子反应方程式______
【答案】CuFeS2 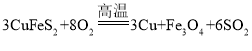 SO2+I2+2H2O=SO42-+2I-+4H+
SO2+I2+2H2O=SO42-+2I-+4H+
【解析】
①分解生成的气体能使品红褪色,该气体为SO2,说明X含有S元素;②用磁分离技术进行分离固体,得到19.2g红色固体单质和23.2g黑色固体,19.2g红色固体单质Cu,X中含有Cu元素。③黑色固体与硫酸反应,再与氢氧化钠溶液反应生成沉淀,将沉淀灼烧生成红棕色固体,则黑色固体为Fe3O4、红棕色固体为Fe2O3,n(Fe2O3)=24g÷160g/mol=0.15mol,由Fe原子守恒可知需要Fe3O4物质的量为:0.15mol×![]() =0.1mol,需要Fe3O4的质量为:0.1mol×232g/mol=23.2g,符合质量变化,故X含有Fe元素。而n(SO2)=13.44L÷22.4L/mol=0.6mol,n(Cu)=19.2g÷64g/mol=0.3mol,由原子守恒可知,X中Cu、Fe、S原子数目之比为0.3mol:0.15mol×2:0.6mol=1:1:2
=0.1mol,需要Fe3O4的质量为:0.1mol×232g/mol=23.2g,符合质量变化,故X含有Fe元素。而n(SO2)=13.44L÷22.4L/mol=0.6mol,n(Cu)=19.2g÷64g/mol=0.3mol,由原子守恒可知,X中Cu、Fe、S原子数目之比为0.3mol:0.15mol×2:0.6mol=1:1:2
(1)由分析中的计算可知X中Cu、Fe、S原子数目之比为0.3mol:0.15mol×2:0.6mol=1:1:2,故X的化学式为CuFeS2;
(2)X在空气存在下高温煅烧的化学反应方程式: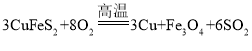 ;
;
(3)X高温煅烧后的气体通入碘水中发生的离子反应方程式:SO2+I2+2H2O=SO42-+2I-+4H+。

 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案【题目】钙钛矿(主要成分是CaTiO3)太阳能薄膜电池制备工艺简单、成本低、效率高,引起了科研工作者的广泛关注,科学家认为钙钛矿太阳能电池将取代硅基太阳能电池的统治地位。
(1)基态Ti原子的价电子排布式为__,能量最高的能级有__个空轨道;Si、P、S第一电离能由小到大顺序是__。
(2)碳和硅的有关化学键键能如表所示:
化学键 | CC | CH | CO | SiSi | SiH | SiO |
键能/kJmol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是___。
(3)一种新型熔融盐燃料电池以Li2CO3和Na2CO3的熔融盐混合物作电解质,则CO32-的空间构型为___。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:
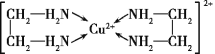
该配离子中含有的化学键类型有__(填字母)。
a.配位键 b.极性键 c.离子键 d.非极性键
一个乙二胺分子中共有__个σ键,C原子的杂化方式为__。
(5)CaTiO3的晶胞为立方晶胞,结构如图所示(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶角)Ca2+的配位数为__,与Ti4+距离最近且相等的O2-有__个;晶体的密度为ρg/cm3,最近的Ti4+和O2-之间的距离为__nm(填计算式)。(CaTiO3的摩尔质量为136g/mol,NA为阿伏加德罗常数)。