题目内容
【题目】X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素,它们能实现如图所示的转化关系(其他物质省略):
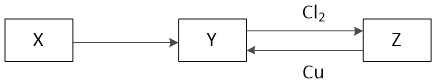
(1)若X是一种生活中使用量最大的金属单质
①写出Z与Cu反应的离子方程式:_____
②如何设计实验检验Z中阳离子:_____
(2)若X是一种非金属单质,常温下为固体,Y是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物。
①写出构成X单质的元素在元素周期表中的位置:_____
②写出Z与Cu反应的化学方程式_____
【答案】2Fe3++Cu=2Fe2++Cu2+ 取少量Z的液体,加入KSCN溶液,若溶液变血红色则含有Fe3+(或取少量Z的液体,加入NaOH溶液,若立即产生红褐色的沉淀则含有Fe3+) 第3周期第ⅥA族 Cu+2H2SO4(浓)![]() CuSO4+SO2 ↑+2H2O
CuSO4+SO2 ↑+2H2O
【解析】
X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素:
(1)若X是一种生活中使用量最大的金属单质判断为Fe,铁为变价金属元素,Y和氯气反应生成Z证明Y为亚铁盐,Z为铁盐,Z与Cu反应为铁离子氧化铜生成亚铁离子和铜离子;
(2)若X是一种非金属单质,常温下为固体;Y是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物,判断Y为SO2,则X为S,Z为H2SO4。
X、Y、Z是中学化学中常见的单质或化合物,且X、Y、Z均含有同一种元素。
(1)若 X 是一种生活中使用量最大的金属单质,则X为Fe,结合图中转化可知,Y为FeCl2,Z为FeCl3。
①Z与Cu反应的离子方程式:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
②设计实验检验Z中阳离子:取少量Z的液体,加入KSCN溶液,若溶液变血红色则含有Fe3+(或取少量Z的液体,加入NaOH溶液,若立即产生红褐色的沉淀则含有Fe3+),故答案为:取少量Z的液体,加入KSCN溶液,若溶液变血红色则含有Fe3+(或取少量Z的液体,加入NaOH溶液,若立即产生红褐色的沉淀则含有Fe3+);
(2)若 X 是一种非金属单质,常温下为固体,Y 是一种能使品红溶液褪色且加热后又能恢复原来颜色的化合物,则X为S,Y为SO2,Z为H2SO4。
①构成X单质的元素在元素周期表中的位置:第3周期第ⅥA族,故答案为:第3周期第ⅥA族;
②Z与Cu反应的化学方程式:Cu+2H2SO4(浓)![]() CuSO4+SO2 ↑+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2 ↑+2H2O,故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2 ↑+2H2O。
CuSO4+SO2 ↑+2H2O。